北京大学王韵课题组发表研究首次揭示了外周感觉神经元中CDYL参与...
本文来源:北京大学 IDG 麦戈文脑科学研究所官网
2022年2月4日,北京大学医学部神经科学研究所、北京大学IDG麦戈文脑科学研究所王韵课题组在《Advanced Science》杂志发表题为“Cdyl deficiency brakes neuronal excitability and nociception through promoting Kcnb1 transcription in peripheral sensory neurons”的研究论文。文章使用分子生物学、生物化学、行为学和电生理学等多种实验方法,揭示了外周感觉神经元中表观调控因子CDYL(chromodomain Y-like)调控痛觉感受及慢性疼痛发生发展,并与合作者共同开发了具有镇痛作用的CDYL特异性小分子抑制剂,为疼痛发病的表观遗传调控机制提供了新启示,也为开发靶向表观遗传修饰的镇痛疗法提供了新思路。慢性疼痛是当今世界一大健康问题,慢性痛患者常伴有情绪情感障碍以及药物成瘾,给社会带来沉重的经济负担。慢性疼痛的病因复杂,现有的镇痛药物疗效有限且副作用明显,全球约有一半以上的慢性疼痛患者仍然得不到有效的治疗,因而对慢性疼痛发病机制的探讨非常必要。在日常生活中,个体的疼痛敏感性和慢性疼痛易感性存在较大的差异,表明慢性疼痛或者急性疼痛的慢性化是环境和基因相互作用的结果,即表观遗传修饰可能在其中扮演重要的角色(Denk et al., 2014)。值得注意的是,当原始的伤害性刺激消除后,其引起的表观遗传修饰模式的变化依然可以长期存在,提示表观遗传修饰在急性疼痛向慢性化的转变中发挥了重要的作用。尽管表观遗传修饰在慢性疼痛发生发展及维持过程中的地位日益重要,然而,若将表观遗传调控真正应用于慢性疼痛的临床治疗,仍存在许多亟待解决的问题:如哪些表观遗传修饰靶点是痛觉信息传递的关键?它们在中枢与外周神经系统中的作用一致吗?它们在何种组织器官、在疼痛病程中哪个阶段的变化最为明显?它们如何发挥表观遗传调控功能?由于表观遗传因子的分布及功能都极为广泛,那么它们调控慢性疼痛的同时是否会产生毒副作用?回答这些问题需要我们对慢性疼痛的表观遗传调控机制进行深入的探讨。CDYL是一个重要的表观遗传调控因子。作为转录抑制子,CDYL主要通过影响组蛋白修饰模式以发挥表观遗传调控功能。王韵课题组和合作者北京大学医学部生物化学和生物物理学系梁静课题组首次发现CDYL可通过抑制BDNF的转录降低树突的复杂程度(J Neurosci, 2014)。进一步地,王韵课题组发现,CDYL抑制RhoA的转录促进神经元迁移,Cdyl缺失促进神经元兴奋性,导致小鼠癫痫易感性增加(Cell Rep, 2017),表明CDYL在神经发育不同时期通过调控不同的下游靶分子发挥不同的作用。并于近期发现了CDYL的首个上游调控分子E3泛素连接酶TRIM32,可神经活性依赖促进CDYL降解,使树突复杂程度增加(FASEB J, 2022)。本研究中,该课题组发现CDYL广泛分布于背根神经节(dorsal root ganglia,DRG)的大、中、小直径神经元中,且外周神经损伤可诱导其表达水平上调。DRG是伤害性感受传导的第一站,可通过初级感觉神经元将伤害性信息上传至中枢神经系统,产生痛觉。使用在体转染技术敲低内源性CDYL含量或使用Cre-Loxp系统条件性敲除Cdyl基因,可降低小鼠对伤害性机械刺激和热刺激的反应性;过表达外源性CDYL可增加小鼠的疼痛敏感性。全细胞膜片钳结果显示,与该课题组之前发现的中枢神经系统中的调控作用相反,外周感觉神经元中Cdyl基因的缺失可降低神经元的兴奋性。ChIP联合高通量测序结果显示,DRG中CDYL的下游分子多参与神经系统功能的调控,如化学突触传递,膜电位调控和离子转运等。其中,延迟整流型钾通道Kv2.1是CDYL痛觉调控过程中的关键靶基因。ChIP-qPCR结果显示,在神经病理性疼痛状态下,CDYL与Kv2.1通道编码基因Kcnb1的内含子元件结合增加,并促进H3K27me3的富集以抑制其转录,从而降低Kv2.1通道的表达。电生理结果显示,Cdyl基因的敲除可增加总钾电流和Kv2.1通道电流的密度,而降低Kv2.1通道的表达可逆转Cdyl基因的敲除对动作电位发放频率和后超极化幅度的影响。此外,下调Kv2.1蛋白含量也可拮抗Cdyl基因缺失对疼痛阈值的升高作用。进一步地,该课题组与合作者合作开发了一种新型特异性CDYL抑制剂UNC6261,电生理及行为学实验结果显示,该抑制剂可显著降低神经元兴奋性并缓解神经病理性疼痛。综上所述,该研究首次揭示了外周感觉神经元中CDYL参与痛觉感受及慢性疼痛发生发展的调控机制。DRG中CDYL表达下调可抑制神经元兴奋性和疼痛信号通路,而其表达增加可促进痛觉敏化的发生,这与CDYL通过招募H3K27me3表观调控Kcnb1的转录密切相关。此外,新型选择性CDYL抑制剂可在神经病理性疼痛小鼠模型中发挥镇痛效应。这些研究结果为疼痛发生发展的表观遗传调控机制提供了新启示,为基于表观遗传调控开发镇痛新疗法提供了新思路。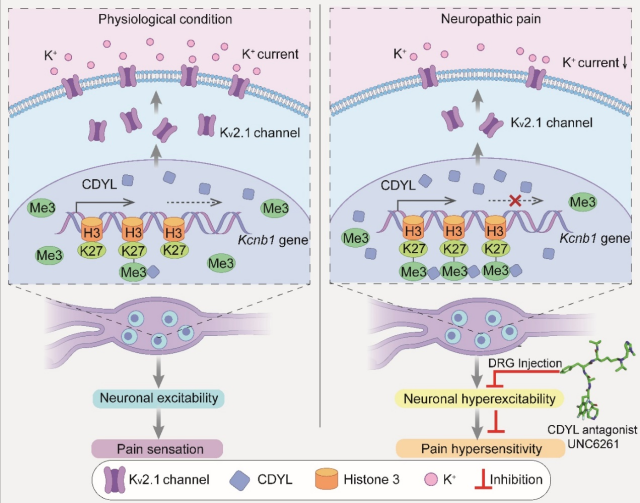 北京大学医学部神经科学研究所、北京大学IDG麦戈文脑科学研究所王韵教授和北卡罗来纳大学教堂山分校的Lindsey I. James教授为该文章的通讯作者,北京大学医学部神经科学研究所2016级直博生孙兆炜是该文章的第一作者。北卡罗来纳大学教堂山分校的Jarod M. Waybrigh博士及加拿大多伦多大学Jinrong Min教授团队对该文章具有重要贡献。该文章得到了国家自然科学基金、科技部重大项目计划的资助。 原文链接http://doi.org/10.1002/advs.202104317
北京大学医学部神经科学研究所、北京大学IDG麦戈文脑科学研究所王韵教授和北卡罗来纳大学教堂山分校的Lindsey I. James教授为该文章的通讯作者,北京大学医学部神经科学研究所2016级直博生孙兆炜是该文章的第一作者。北卡罗来纳大学教堂山分校的Jarod M. Waybrigh博士及加拿大多伦多大学Jinrong Min教授团队对该文章具有重要贡献。该文章得到了国家自然科学基金、科技部重大项目计划的资助。 原文链接http://doi.org/10.1002/advs.202104317
本文内容转载来源以上网址及公众号。以上内容仅供学习使用,以上观点不代表本公众号,不作其它用途,如有侵权,请留言联系,作删除处理!
有任何疑问及建议,扫描以下公众号二维码添加交流:
