Nature Methods | 中山骆观正实验室在RNA修饰方法学领域取得重要进展
RNA分子在生命出现伊始就存在,在漫长的演化历程中,逐渐从生命信息存储和表达的双重身份中特化出来,成为信息传递的媒介。处于中心法则中间的RNA,既不像DNA存储遗传信息,也不像蛋白质直接体现生命活动,只在少数特例(如病毒、核酶)中提醒人们它仍然保留来自远古的使命。近年来,表观转录组学(epitranscriptomics)的提出为该领域注入了新的思想【1,2】。人们发现,真核生物不同种类RNA上存在超过150种化学修饰,其中很大部分继承于古老的共同祖先。这些修饰或参与了RNA与其它大分子的互作,或影响了RNA本身的代谢,在生命过程中起着至关重要的作用【3,4】。
准确且定量地鉴定RNA修饰位点及其修饰比例,是深入了解RNA修饰的分布、功能及其背后的机理机制的前提。然而如何得到高置信度、单碱基精度RNA修饰位点,以及对修饰位点的精准定量,目前仍然是领域内的研究难点。近年来,多种新技术的出现使得检测全转录组中的各种RNA修饰位点成为可能【5,6】。尽管已有多种RNA修饰检测方法可供选择,但是在实际应用中效果往往差强人意。高假阳性率、低分辨率的问题时常困扰研究者。某些情况下,不同研究报道的同一种修饰的位点数甚至能相差2-3个数量级【7】。即使是目前相对成熟、应用最广的MeRIP-seq技术,也存在大量非特异性抗体富集和低重复性问题【8,9】。

为了解决RNA修饰检测中所面临的方法学难题,我们提出了一种新的研究策略。通过构建全转录组无修饰RNA文库作为负对照,全面评估了现有的基于二代测序的RNA修饰检测技术,并为修饰位点的精确鉴定提供系统的解决方案。该研究成果于9月30日发表在Nature Methods杂志上,题为“Systematic calibration of the epitranscriptomic maps using a synthetic modification-free RNA library”。实验室副研究员张璋和博士后陈涛为共同第一作者,骆观正教授为通讯作者。陈鸿萱、谢应源、陈丽倩、赵玉莉、刘标地、马冬曌、柴国师、张莹、赵文烁等同学也对该工作做了贡献。同时工作还得到了广州健康院的陈捷凯研究员、北京大学贾桂芳研究员和本院杨建华教授的帮助。以下是对文章的解读。
面对噪音较大的生物数据,引入对照来鉴别假阳性是经典的思路。在前人的研究中,为了提高现有RNA修饰检测方法的可信度,有时会利用负对照样本对结果进行校正。比如有研究使用敲除甲基转移酶(“writer”)的样品,或者利用去甲基化酶(”eraser”)在体外反应中获得去除修饰的样本,亦或是使用合成的无修饰的RNA oligo作为对照。然而这些负对照样本身存在较大的不足,比如体外反应很难完全去掉修饰位点,合成的RNA oligo只能代表部分序列等。因此,最好的负对照样本应该具有与内源转录组同样的序列和基因表达水平,但是并不含有修饰碱基的一套完整的人工转录组。本研究采用体外合成全转录组RNA (IVT RNA) 文库的方法构建了无修饰的RNA文库(图1),随后将其作为负对照用来校正现有的修饰检测方法。文中以两种最受关注的RNA修饰m6A和m5C作为代表,分别验证了该方法在三种典型研究场景中的有效性(图2)。
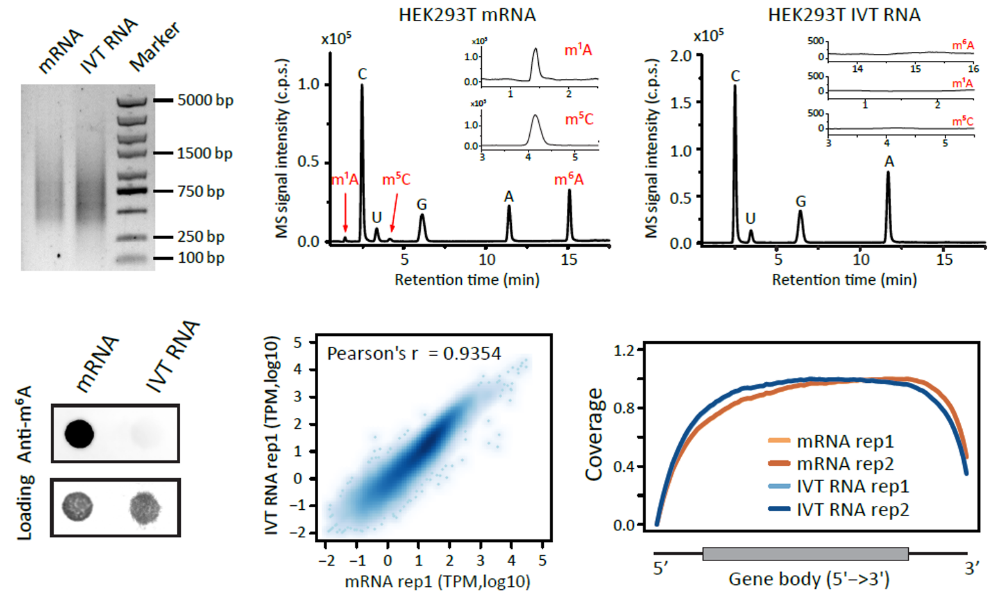
图1 体外合成RNA文库(IVT RNA)具有与内源转录组相似的表达量,但不含有修饰碱基
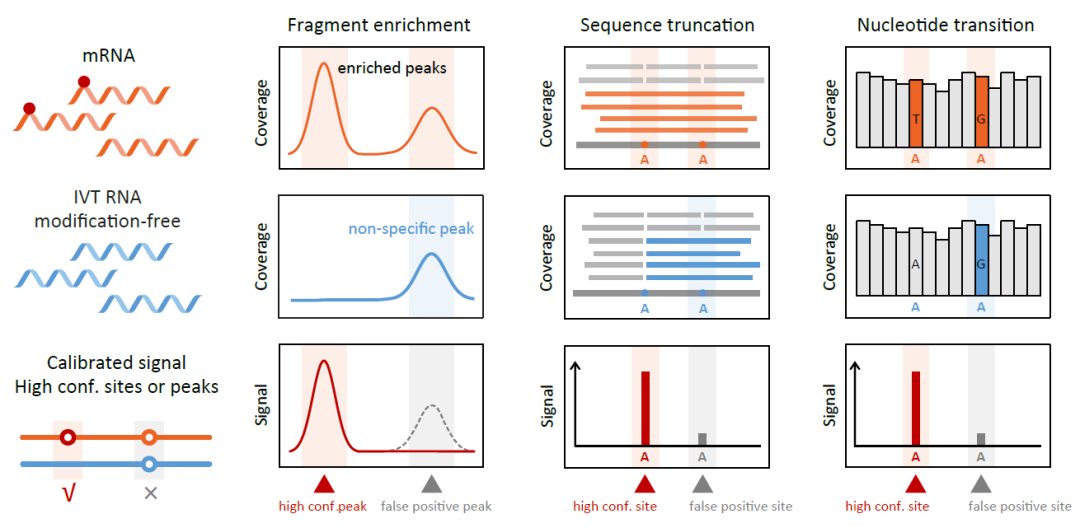
图2 使用IVT RNA校准RNA修饰检测的三个应用场景
MeRIP-seq(或m6A-seq)是目前最常用的RNA修饰检测方法,被大范围地用在m6A相关研究中。该方法原理是用m6A特异性的抗体对片段化的RNA进行免疫沉淀反应,将含有m6A的片段富集出来进行测序。在研究中,我们同时对体外转录IVT RNA文库也进行MeRIP-seq,结果表明即使是对不含m6A修饰的IVT RNA文库,抗体依旧能够富集到大量RNA片段,并且这些富集的“peak”在已发表结果数据中重复出现,表明MeRIP-seq其实受到假阳性信号的严重干扰。分析IVT RNA中被富集的“peak”区域,发现这些区域所在的基因表达量较高且富含腺嘌呤。去除假阳性信号后,鉴定出来的修饰区域更准确(图3)。
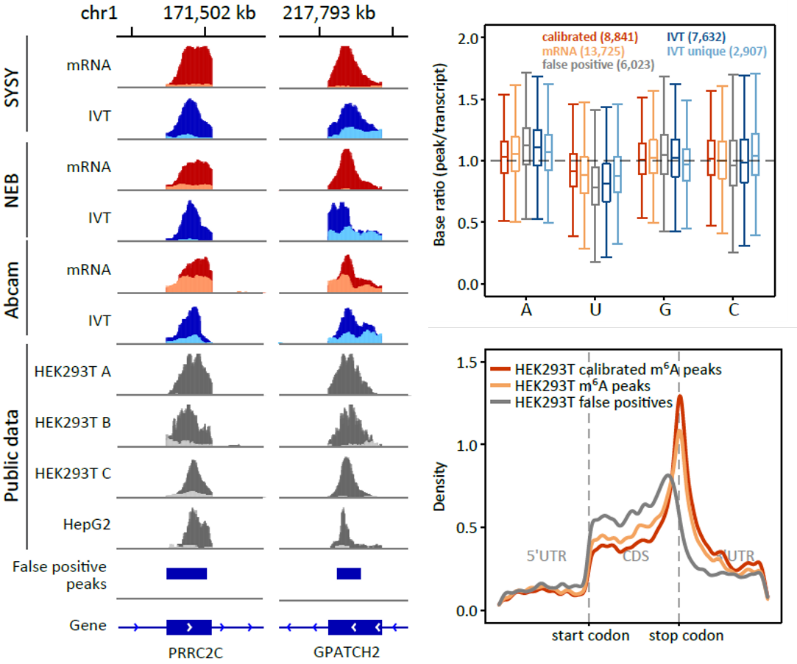
图3 使用IVT RNA文库对MeRIP-seq进行校正 (高通量数据分析必备|基因组浏览器使用介绍 - 1)
m6A-REF-seq是一种借助m6A敏感内切核酸酶MazF来实现的m6A单碱基检测方法。该方法由本课题组和以色列魏茨曼科学研究学院Schraga Schwartz组在2019年分别独立发表【10,11】。在本研究中,我们将IVT RNA样本作为负对照进行m6A-REF-seq校正,发现确实存在大量假阳性位点。高精准度的m6A单碱基图谱也为领域提供了新的知识,如扩展motif序列,定量分布规律等,为进一步深入分析m6A的机制和功能创造了前提。通过对假阳性位点的深入分析,发现某些特定序列和RNA二级结构会干扰MazF酶切反应,是产生假阳性的主要原因(图4)。
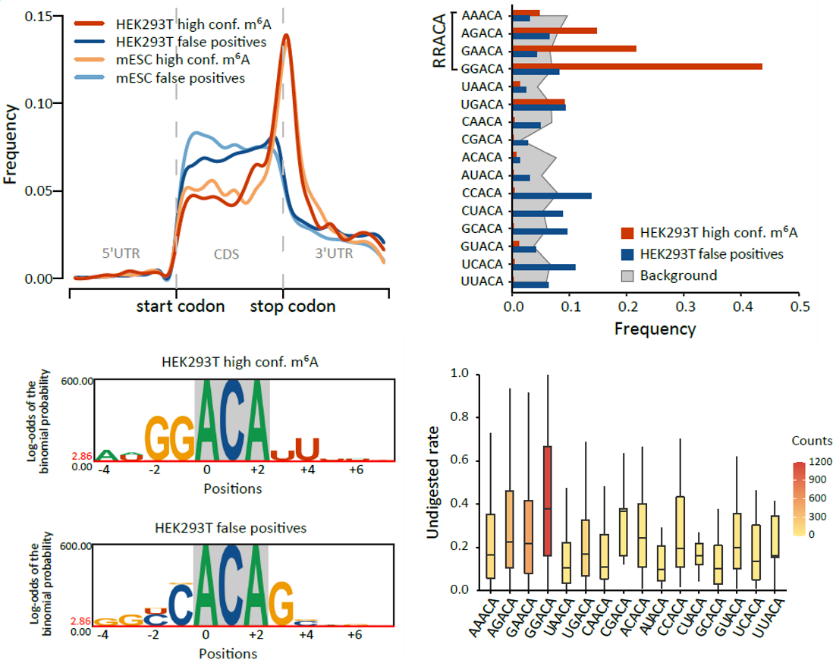
图4 使用IVT RNA文库对m6A-REF-seq进行校正 (R包ggseqlogo |绘制序列分析图;推荐一款高颜值免费在线SCI绘图工具~~~)
最后我们将IVT RNA应用到另一种常见RNA修饰m5C的检测中。BS-seq使用重亚硫酸盐对不含修饰的C进行处理,使其在PCR之后转换为T,而m5C修饰并不能进行该转换。因此,在实验中如果对RNA处理不完全,将会引入大量的假阳性位点。我们在BS-seq中加入IVT RNA作为负对照,得到高置信度的m5C位点,同时发现即使重亚硫酸盐处理得不是非常严格,引入IVT RNA依然能够起到明显的校正效果,降低了检测结果中的假阳性率。
综上,本文提出了一种体外合成全转录组无修饰RNA的技术,并应用于三类主要的RNA修饰检测方法中,系统性地对常用的RNA修饰检测方法进行评估和校正,提高了修饰位点检测的准确性,获得了高置信度位点信息和定量图谱。相对于使用体内敲除甲基转移酶样本作为负对照,该方法可以保证合成的RNA库完全无修饰,且可以通过简单的方式快速获得,不受物种和样本本身的限制,有望成为目前和未来RNA修饰检测的金标准。
文 末 福 利
中山大学骆观正实验室建立了最先进的核酸修饰研究平台,并拥有自主知识产权。期待感兴趣的同僚一起探讨交流。并欢迎一切可能形式的合作。
本文链接(点击 ”阅读原文“ 跳转)
https://doi.org/10.1038/s41592-021-01280-7
文 / 张璋
编 / 兰烨琳
审 / 陈鸿萱
往期精品(点击图片直达文字对应教程)
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集