创新药出海,已经“刹不住了”


出海是国际化药企搭建海外市场的重要一环,但并不是所有Biotech的必要选择。
全文4529字,阅读约需9分钟
文|肖伞伞
编辑|刘聪
来源|亿欧健谈
ID:EO-Healthcare
题图|Pexels
北京时间3月1日,在被延期三月之后,传奇生物自主研发的CAR-T产品西达基奥仑赛成功叩开了FDA的大门,给局势暂不明朗的中国生物医药注射了一剂强心针。
这是第一个成功在美国上市的国产CAR-T产品、也是全球第二款基于BCMA靶点的CAR-T产品,将用于治疗复发/难治性多发性骨髓瘤成人患者。消息一出,传奇生物股价闻风而动,当日涨幅超10%,一扫国内创新药往日阴霾,不少人感叹“FDA的大门又向中国生物医药敞开了”。
对于创新药企来说,近两年日子可不太好过。同质化竞争激烈,历经“死亡之谷”成功上市后,又面临国家医保谈判“大砍刀”。市场空间被不断压缩,以PD—1为例,价格从几十万打到几万,天花板不断压低,大大削减了创新药的利润。寒冬下,药企迫切需要一个新支点撑起创新药的高回报,“去海外”已成为企业共识。
据不完全统计,2021年中国生物制药领域共产生跨境交易license-out 41笔,远超近几年数量。在金额上,交易金额均价升高,百济神州单笔交易总额直接逼近30亿美元,创下国内单品授权合作金额最高纪录。
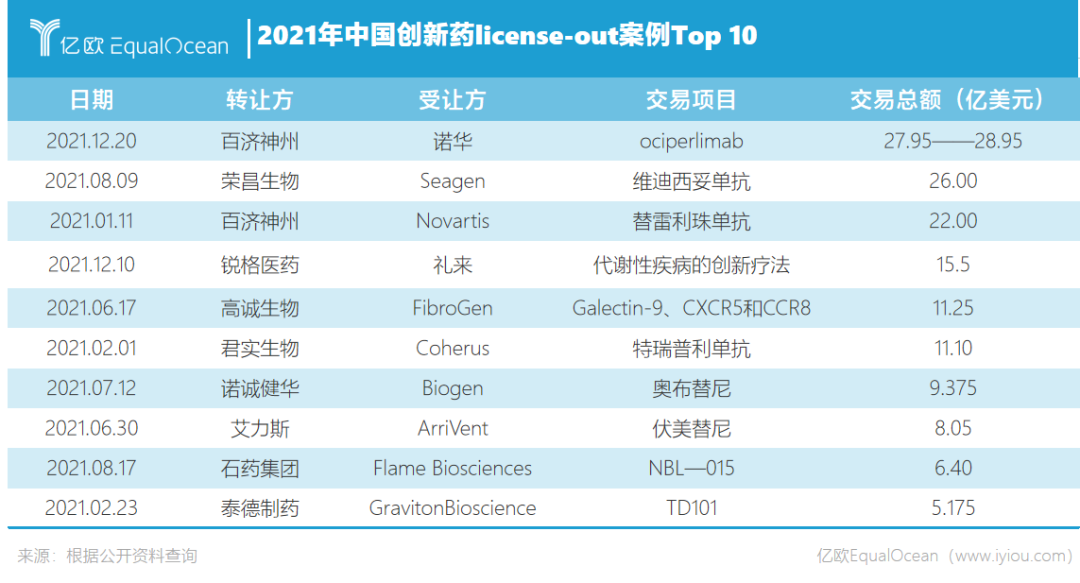
这背后是中国创新药不断发展的有力验证。西南证券数据显示,2021年,中国全球创新药总交易数量达到981次,仅次于美国,合计交易金额达到1759亿美元。此外,中国医药工业信息中心统计,2021年,中国获批的创新药通用名数量高达68个,较2020年的获批数量增加了50%。其中,国产获批数量占比42.6%,创下历史新高。
创新药获批数量、交易金额均有大幅增长,与此同时,出海存在诸多不确定性,蓄力出海的创新药企该向何方驶去?

“后浪们”闯关FDA
西达基奥仑赛成功出海具有里程碑意义,其成为首款获FDA批准的国产CAR-T疗法,也为即将迎来FDA大考的企业们提振信心。
2021年我国有8款创新药的NDA(新药申请)或BLA(生物制品许可申请)获FDA受理,2022年将会有多家药企闯关FDA,出海之势势头不减。
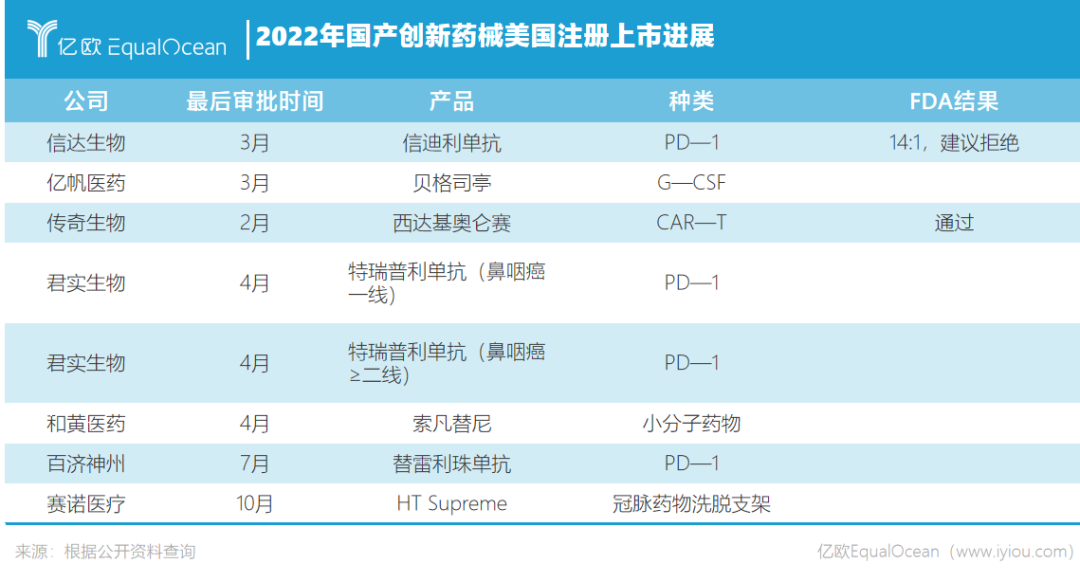
而最瞩目的,莫过于其他两家国产PD—1的角逐。信达生物打响了中国PD-1出海的第一枪之后,谁能夺得首张海外门票颇受关注。
君实生物的特瑞普利单抗瞄准了鼻咽癌,针对复发或转移性鼻咽癌申报了两项BLA,分别为联合吉西他滨/顺铂用于一线治疗和单药用于二线治疗,其中一线适应对应的是JUPITER-02研究,为国际多中心临床研究。
鼻咽癌在美国患者规模并不大,据世卫组织统计,2020年鼻咽癌的全球新确诊病例数达13.3万,其中半数还在中国。且君实生物的PD—1为全球首个获批鼻咽癌适应证治疗的PD—1单抗(2020年4月),不存在对照为免疫治疗的问题。
君实生物延续“小适应证开启快速上市通道”路线,目前已获得FDA授予的2项突破性疗法认定、1项快速通道认定、1项优先审评认定和4项孤儿药资格认定。君实生物董秘曾向投资者介绍,特瑞普利单抗鼻咽癌适应证的BLA完全符合FDA关于“未满足临床需求”的认定,整体方案也在此前获得FDA认可,无需开展“头对头研究”。
FDA肿瘤卓越中心主任Richard Pazdur博士曾在近日采访中指出,监管机构在患者数据问题上的灵活性程度将取决于产品的创新程度,也可能取决于美国与外国在疾病流行率方面的对比。特瑞普利单抗能否乘“未满足的临床需求”之势顺利获批?仍待回答。据悉,FDA不计划召开ODAC会议审评该BLA,拟定的PDUFA目标审评日期为2022年4月。
紧随君实生物之后,百济神州的替雷利珠单抗食管鳞癌适应证将于2022年7月12日“赶考”。
替雷利珠单抗的全球3期临床试验是几款 FDA 申报国产PD-1中唯一纳入北美患者的临床试验,该试验纳入了512例来自亚洲、欧洲、北美的11个国家或地区的患者,近40%的患者是在中国以外招募,其中也覆盖了美国多个临床试验中心。
去年6月,百济神州公开试验结果显示,该研究的主要终点即意向性治疗(ITT)人群的中位总生存期(OS)达8.6个月,降低死亡风险超过 30%,且客观缓解率(ORR)达 20.3%,均显示出具有统计学显著性和临床意义的OS改善。无论是从入组患者多样性,还是试验设计均符合FDA监管标准。
在历经FDA监管大考之后,中国创新药的出海将愈发常态化。暂且不论是否成功,至少锻炼了药企的综合能力,为其“强筋壮骨”。

Biotech分流,出海成强者游戏
“国际多中心临床试验已成为创新药出海的第一道关卡。”百济神州副总裁、大中华区市场营销负责人刘焰向亿欧大健康说到。她指出,如果药企想走国际化这条路,需要考虑布局全球多中心的研究,不同人种的患者数据对于全球获批是至关重要的。
海外市场,并非是药企触手可得的“香饽饽”。以国际多中心临床试验为例,其往往涉及两个以上的国家,几十个甚至几百个临床试验点,临床试验方案也更为复杂。在刘焰看来,药企出海需要临床试验的研发团队及运营团队对国际标准、入组患者的入排标准、试验质量控制有严格的把握,注册能够非常熟悉法规的各项的要求,诸如此类能力都是非常重要的。
随着一些治疗领域竞争激烈,有些产品的获批,甚至需要“头对头试验”。所谓“头对头试验”,是以临床上已使用的治疗药物或治疗方法为对照的临床试验,投入成本相较于以往并非一个量级,难度也大大增加。此前,百济神州研发负责人汪来曾透露,在BTK抑制剂泽布替尼的头对头试验中,仅购买对照药伊布替尼就花了1亿美元,整个试验历时三年多。对药企来说,出海成本将大幅增加。
国际多中心临床试验门槛高、耗时长、资金多,出海还会是当下Biotech的最优选择吗?
刘焰分析到,目前Biotech可以分为两种:一种Biotech希望成为Biopharma,甚至未来成为Bigpharma。这是一条路,它除了自己研发产品,也可以走商业化。对于这样的企业,出海需要筹谋布局;另外一种Biotech,强项在研发,可以一直做Biotech,产品管线上有更多产品研发出来,以此去和其他公司合作或者卖给其他公司。
随着2017年中国加入ICH、香港18A政策对未盈利生物药企打开闸门,在政策、资本、人才的多重助力下,创新药发展迎来黄金期,无数的Biotech怀揣着成为Biopharma的愿景开启了管线。
但现实情况并不乐观。医药自媒体阿基米德Biotech创始人廖磊近日曾公开表示,今年已经有4家港股18A公司处在现金耗尽的危险阶段。从现金储备上看,如果经营融资状况改善,大约30%港股18A公司在2024年面临现金耗尽的境地。
“之所以这么内卷,是因为不需要这么多的Biopharma。无论是研发还是商业化,前期投入都比较高。账上资金能不能支撑公司既搞研发又搭建商业化团队?”刘焰认为,Biotech要对自己的战略定位非常清晰,知晓自己的核心竞争优势,才能有更好的发展。
出海是国际化药企搭建海外市场的重要一环,但并不是所有Biotech的必要选择,只有那些具备造血、输血能力药企可以承担高额成本,出海亦成为药企更高门槛的竞技。
从FDA的审评风向来看,“满足未被满足的临床需求”一时间成为业内共识,也被视为创新药物出海最重要的特性。上述受访人士指出,《以临床价值为导向的抗肿瘤药物临床研发指导原则》意见的出台,已经明确药物研发以临床价值为导向。在治疗领域,药企以满足和解决“未被满足的医疗需求”为出发点。从立项开始,对产品的的布局、研发试验、未来的商业化战略上都要有一个全球的规划以及通盘考虑。

出海美国,中国创新药有得选吗?
FDA对国产PD-1态度突然转变、让很多人思考,如果FDA难度太高,是否可以转战欧盟、一带一路及亚非拉国家?
刘焰指出,各个国家的市场容量和支付能力不尽相同,如果想惠及更多一带一路的国家或亚非拉国家,不要寄予过高的赚钱期望,可能更多是让研发的产品惠及更多的患者。
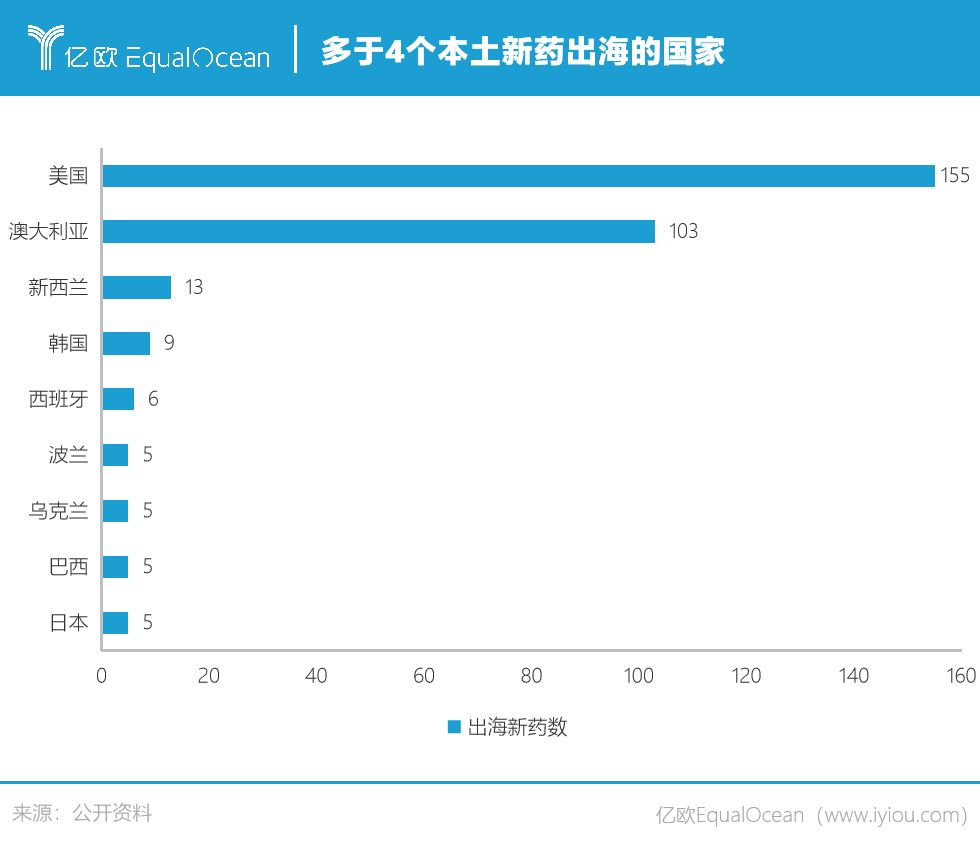
看似选择余地很多,布局美国市场依然是众多药企的首选。来自智能药物大数据分析平台Pharma ONE的数据显示,本土新药出海美国数量高达155个,成为当之无愧的第一热土。澳大利亚出海新药数量以103个位居第二。
市场规模,决定了药企的销售上限。早在2018年,美国医疗开支就已达3.65万亿美元,接近美国GDP的20%;人均处方药1150美元,平均药物价格是其他发达国家的3倍。最重要的一点就是,FDA批准的药物拥有自由定价权。美国政府是美国处方药最大的采购商,但2003年小布什颁布Medicare Part D,称作《医疗保险门诊处方药付费法》。该法案明确规定,禁止政府(HHS,Health and Human Service)与制药商谈判药物价格,重申药物自由定价原则。
根据处方药比价平台GoodRx最新报告数据显示,在2021年12月29日至今年1月31日之间,至少有155家生物制造公司提高了药品价格,价格平均涨幅达到了5.1%。专利政策与定价权的保护,为药企生存和发展创造了良好的环境,也涌现出修美乐、K药、O药等多款现金奶牛。
高回报率使美国成为药企掘金的第一圣地。为了加快药物上市速度,2012年7月,《美国食品药品监管安全和创新法案》正式提出新药“突破性疗法药物”审评通道,继已有的“快速通道”、“优先评审”和“加速审批”进行了补充。与其它快速通道认定的信息不同,突破性疗法认定要求初步临床证据,和治疗严重疾病的现有药物相比,疗效具有实质性改善。
仅2021年一年,我国至少有9款创新药获得FDA突破性疗法认定或快速通道资格。获得突破性治疗药物认定的新药,可以享受FDA的各种“照顾”。不仅可以分阶段递交已完成的申报材料,还可获得高效的审评员指导,有效规避研发过程中的“坑”。
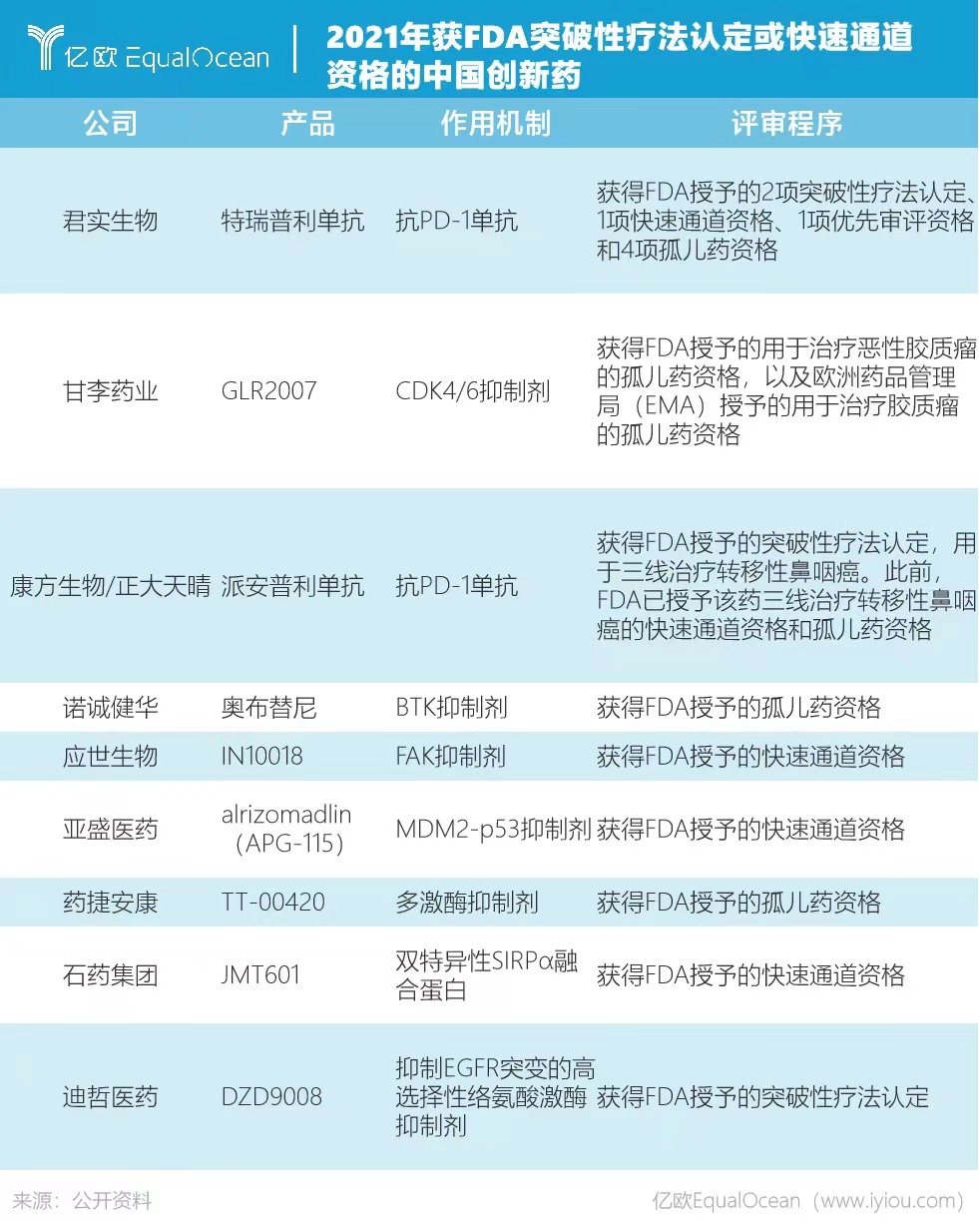
众多药企蓄势待发地闯关FDA,背后用意不言自明:拿下FDA的入场券,几乎拿到了全球药品销售的门票。一旦获得了美国FDA的上市批准,也就意味着在亚洲、拉丁美洲、南美洲,中东和非洲能通过药品证书CPP(Certificate of Pharmaceutical Product)申报上市。百济神州的BTK抑制剂泽布替尼,在成功敲开美国FDA大门获批上市之后,又成功在40余个国家获批。
“出海之路肯定不会越走越窄,现在国内有这么多的创新公司,也在为源头创新不懈努力。未来我相信会有更多的企业在国际化道路上有所收获。”刘焰说到,医药领域还有许多未满足需求存在,如果创新药企能做出First-in-class、Best-in-class的新药,以性价比优势取胜,也能走出一条阳关大道。
回溯来看,信达PD-1以开拓者的姿态为创新药征战FDA迈出了关键一步,虽有折戟阵痛,但带给国产创新药更多思考。FDA收紧药物审批已成趋势,药企如何满足未被满足的临床需求,设计符合FDA监管标准的临床试验,依据临床格局变化主动调整自己的临床研究策略至关重要。
穿越寒冬,创新药企也将收获自己的海外硕果。
本文首发于亿欧网2022年2月26日(内容有改动)
本文由亿欧健谈授权亿欧发布,申请文章授权请联系原出处。