冻存样品对单细胞测序影响大吗?
生物信息学习的正确姿势
NGS系列文章包括NGS基础、高颜值在线绘图和分析、转录组分析 (Nature重磅综述|关于RNA-seq你想知道的全在这)、ChIP-seq分析 (ChIP-seq基本分析流程)、单细胞测序分析 (重磅综述:三万字长文读懂单细胞RNA测序分析的最佳实践教程)、DNA甲基化分析、重测序分析、GEO数据挖掘(典型医学设计实验GEO数据分析 (step-by-step))、批次效应处理等内容。
在我们做单细胞分离过程中,导师千叮咛万嘱咐说样品不能冻存,而我在一次会议论坛上有一位学者直接说冻存基本没有影响,于是,我。。。。。。母鸡。

2019年12月31日(真是抓住了2019的小尾巴!),英国Wellcome Sanger Institute研究团队于Genome Biology发表了题为scRNA-seq assessment of the human lung, spleen, and esophagus tissue stability after cold preservation的研究内容,探究样品冻存和冻存时间对人体肺脏、脾脏和食管组织单细胞转录组测序的影响。
研究背景:
为了解决在组织解离或储存时引起的快速转录变化/应激反应,已经开发了一系列细胞冷冻或固定方法。Guillaumet-Adkins等证明,培养细胞或切碎的小鼠活检组织在DMSO冷冻保存后尽管活力降低,但转录谱并没有发生明显改变。但是,某些类型的细胞比其他类型的细胞在冷冻时更容易收到伤害,例如,在人子宫内膜活检中,基质细胞比上皮细胞在冷冻条件下存活率更高。另外,有研究评估了用传统的交联固定剂,可逆交联剂,非交联替代品(例如甲醇)和其他新型稳定剂固定细胞的能力。固定虽然通常会产生3’偏倚,但可以阻止转录变化并保证细胞类型不发生变化。迄今为止,只在解离的细胞或至多切碎的组织上测试了这些试剂,而在完整的组织样品上尚未进行测试。不幸的是,在运输之前对人类临床样品先进行解离通常是不实际的,并且使用传统的机械或酶解方法来解离固定的组织块通常是比较难的。
在这项研究中,作者旨在确定一种组织保存方法,可以在最少的临床处理和一定的运输时间内保证用于scRNA-seq的完整组织样本的转录状态保持稳定。为了有助于人类细胞图谱项目,作者在对缺血具有不同敏感性的三种人类原发组织上测试了该方法:脾脏(最稳定),食道粘膜和肺部(最不稳定)。这些组织包含从免疫细胞到角质形成细胞等多种不同细胞类型。从死去的器官捐献者身上采集样本,并在捐献者死亡后迅速用冷器官保存液进行灌注。
该研究产生的24万个单细胞数据集包括迄今为止人类食道和脾脏最大的公开的单细胞数据集。数据可以在www.tissuestabilitycelllas.org浏览分析。研究发现,将这3个器官的完整组织块保存在4摄氏度的HypoThermosol FRS中24h或72h(大部分样品是保存72h),再进行普通和10x 3’富集单细胞转录组测序,转录图谱几乎没有影响。scRNA-seq得到的群体多样性结果未随冷冻时间变长而发生变化。该方案应该很容易被许多临床机构采用,并允许至少24小时的时间窗口以便将样本运送给合作者,因此增加了获得新鲜人体组织进行研究的机会。
研究内容:
1. 冷藏后scRNA-seq数据质量良好
作者从12个器官供体获得了肺、食道和脾脏样本,并利用全基因组测序和病理学切片评估,样品都为健康样品,以免样品中存在一些腺体或炎症影响到scRNA-seq结果的评估。将新鲜样品立即解离(T0)或在4°C下保存12h、24h和72h的冷缺血时间再解离,然后通过10X 3’ v2 scRNA-seq进行单细胞测序。如下图所示,在对scRNA-seq数据进行比对和标准化后,评估所有样品的质量控制指标。对于肺和食道,每个样本的reads数、每个样本的细胞数、每个细胞检测到基因数目的中位数以及其他质量指标并未随时间显著变化,但是脾脏器官冷藏保存72小时的样品的reads比对率降低明显。
结论:作者没有检测到在冷缺血时间的24小时内与冷藏时间长度有关的质控指标变化。(【冷缺血时间】:器官从冷灌注(冷保存)开始到移植后供血开始的这段时间。)
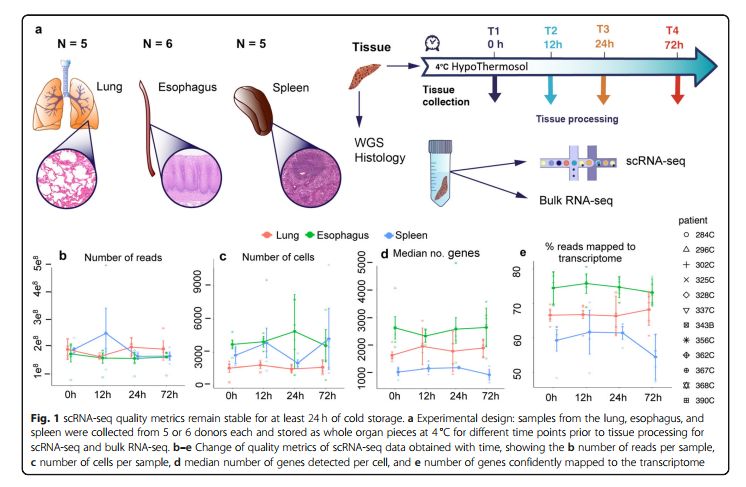
图1
2. 冷存72h脾脏样品中scRNA-seq数据质量降低
进一步细化分析发现仅在脾脏中观察到外显子reads数百分比显著下降(图2a,b)。此外,仅脾脏样品中内含子的reads百分比随储存时间的增加而增加(图2c,d)。脾脏在72h时高质量reads的比例变化(图2b,c)可能会导致细胞类型特异性差异,这将在后面结果进一步探讨。这一比对到内含子和外显子的reads的比例变化在top 25%高质量外显子reads和top 75%高质量内含子reads中变化更明显,该结果暗示非剪接的reads对于降解更稳定 (这个结论得出的有些奇怪,有熟悉的朋友还请指导下)。最后研究人员也发现线粒体基因表达百分比仅在脾脏中随时间显著增加(图2e,f,g)。
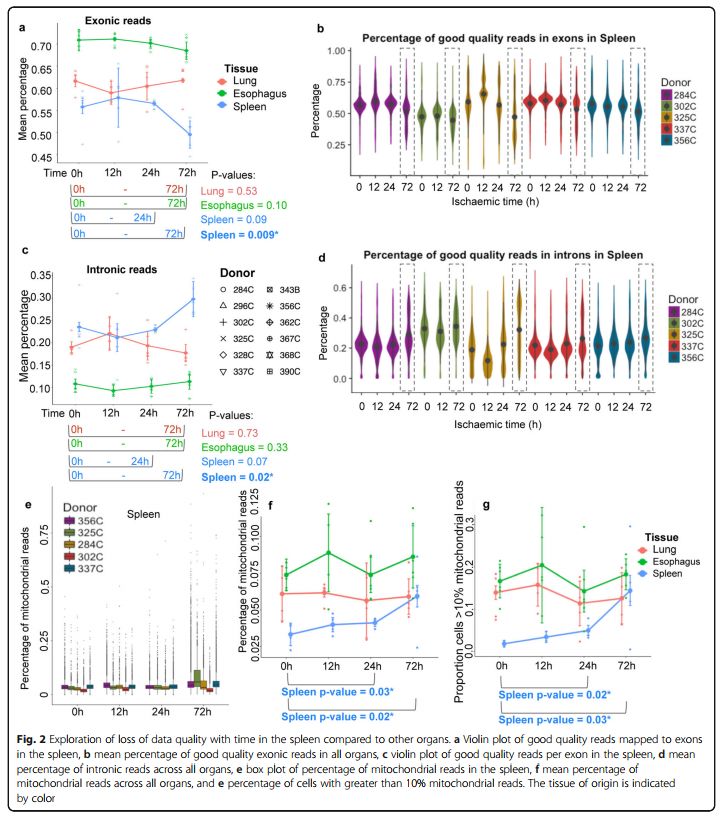
图2(R语言学习 - 箱线图(小提琴图、抖动图、区域散点图))
3. 时间对doublet rates和empty droplets的影响
首先是三个组织中液滴的Doublet得分均不随时间变化。
接下来,作者评估了non-cellular droplets的变化。所有基于液滴的测序反应均产生许多不包含细胞但捕获环境中的mRNA的液滴,通常称为ambient RNA或 soup。针对每个液滴的测序深度标准化后的UMI数设置了一个相对随意的阈值,将ambient RNA定义为0-0.25,debris定义为0.25-5,cellular materia定义为> 5 normalized UMI per droplet来反映reads的分布(图3a)。脾、肺或食道样品中冷存时间对含UMI的液滴比例无明显影响。脾脏中debris类型的液滴中的normalized UMI的平均数于72h增加而cellular droplets却减少(图3b,c),肺或食道样品中未观察到此现象。但3个器官的debris 和cellular material的液滴平均normalized UMI都变化较大。
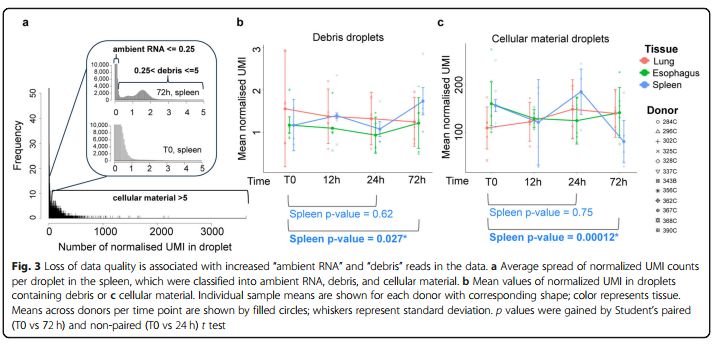
图3
4. 细胞类型注释
在肺中,57,020个细胞通过了质量控制并注释为25种细胞类型。从血液和淋巴管中检测到纤毛、肺泡1型和2型细胞、成纤维细胞、肌肉和内皮细胞。从免疫区室鉴定出的细胞类型包括NK、T和B细胞、两种巨噬细胞、单核细胞和树突状细胞(DC)。检测到多个DC细胞亚群,例如cDC1,浆细胞样DC(pcDC)和激活的DC,分别占所有细胞的0.3%(163个细胞),0.08%(46个细胞)和0.2%(122个细胞)。在少数细胞中检测到肺泡club细胞标记基因,但聚类算法未将这些细胞单独聚类 (这个分类的分辨率也是很高的,46个细胞的类群都可以分出来,可能是初始分辨率设置的高,也可能是做了细胞簇细分。分簇虽然比较直观,也需要反复尝试。尽可能分出更多有意义的簇,也要保住分簇结果的稳定性。)。
食道样品质控后剩余87,947个细胞,其中90%以上属于四种主要上皮细胞类型:upper, stratified, suprabasal, 和 dividing cells of the suprabasal layer。来自上皮基底层的其他细胞更紧密地聚集于腺管和粘液分泌细胞。食道中的免疫细胞包括T细胞、B细胞、单核细胞、巨噬细胞、DC和肥大细胞。有趣的是,几乎80%的肥大细胞(87个细胞)来自单个供体。在该供体中还发现其他免疫细胞(B细胞,DC,单核细胞/巨噬细胞)的比例增加。这个供体诊断有呼吸机相关性肺炎,后期比较中已排除。
来自脾脏的所有94,257个细胞均标注为免疫细胞。卵泡B区和mantle zone B区细胞被认为是最大的细胞组群,分别占17%(> 16,000个细胞)和20%(> 18,000个细胞)。检测到超过6000个浆细胞并标注为浆母细胞,且浆细胞表达IgG或IgM。超过28,000个T细胞被标注为CD4 +经典、CD8 +活化、CD + 4 naive、CD4 +卵泡辅助细胞(fh)、CD8 + MAIT样、CD8 +γ-δ、CD8 +细胞毒性淋巴细胞(CTL)、CD4 +调节性或分裂T细胞。还确定了自然杀伤(NK)细胞的两个亚群、一个分裂期的NK亚群、单核细胞、巨噬细胞和DC。多个细胞群的比例非常低,例如DC亚群,包括激活的DC(0.04%)、常规DC1(0.3%)和pcDC-s(0.3%),以及先天性淋巴样细胞(0.6%)、CD34 +祖细胞(0.2%)、血小板(0.08%)和位于T和B细胞簇之间的未知细胞群(0.1%)。包含2207个以上同时表达T细胞和B细胞标记的细胞亚群可以代表相互作用细胞的doublet,称为T_B doublet。
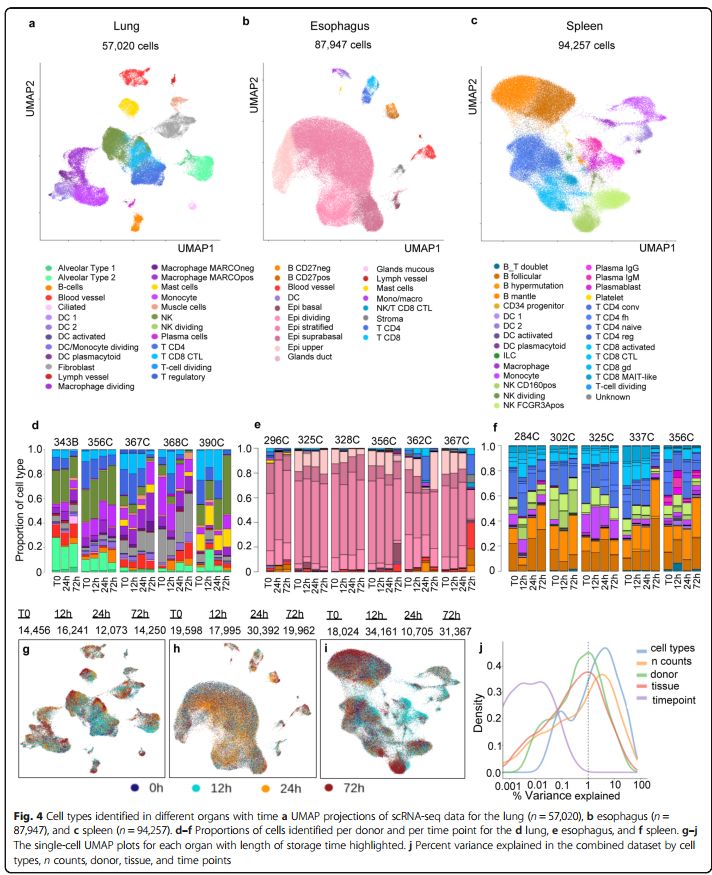
图4
5. 特定细胞类型的变化。
注释了细胞类型后,可以研究细胞类型组成比例随冷存时间的变化。样品之间和供体之间的细胞类型比例差异很大。当检查供体中细胞类型随时间的变化时,我们注意到脾脏(图4f)中B细胞的比例随存储时间增加(关注图中橘色系柱子区域),而肺(图4d)和脾脏(图4f)中T细胞(关注图中蓝色系柱子区域)的比例则随存储时间减少(图4d-f, d lung, e esophagus, and f spleen) (生信宝典注:d,e,f子图与a,b,c是分别垂直对应的,但各自图上加一个标题标记器官名称会更易于图的解读)。
接下来,作者检查了存储时间对转录组是否有细胞类型特异性的影响。值得注意的是,根据高度可变的基因计算出的UMAP图并没有随时间明显变化(图4g,h)。整合所有组织的基因表达矩阵,并计算了由不同变量解释的变异性百分比。如图4j显示,不同的供体、组织、细胞类型和细胞UMI总数解释了最高比例的方差来源,而存储时间的影响最小(紫色线)。(如果你也想做这个分析,见文章如何火眼金睛鉴定那些单细胞转录组中的混杂因素)
结论
作者提出了一种用于冷藏人体原始组织样品的方法,该方法不需要在临床现场进行除样品采集以外的任何处理,并且给运输、组织解离和scRNA-seq测序的至少24小时的操作时间。肺和食道样本所有质量指标在冷藏72h内保持稳定。在脾脏中,我们观察到72h时内含子和外显子reads比例的变化以及线粒体reads百分比的增加。
结果表明组织样品收集后立即放入冷组织保存溶液可以保证各种不同细胞类型在缺血后受影响最小。冷存时间对scRNA-seq数据中的细胞群体多样性或24h内bulk RNA-seq的变化不存在影响。
另外作者提供了肺、脾脏和食道的数据资源,涵盖单细胞、普通转录组、全基因组测序和临床数据等,供领域科学家进一步分析使用。
这么大的数据量只发了一篇Genome biology,是不是有些大材小用了,那么这个数据资源是否还可以再深挖呢?
| 作者:张虎
| 校对:生信宝典
参考文献:
Madissoon E, Wilbrey-Clark A,et al scRNA-seq assessment of the human lung, spleen, and esophagus tissue stability after cold preservation. Genome Biol. 2019 Dec 31;21(1):1.推荐阅读
往期精品(点击图片直达文字对应教程)
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集