物理实验设备与新冠病毒研究
日期:2020年08月08日
正文共:7170字3图
预计阅读时间:19分钟
作者:李昭辉
注:本文原文发表在2020年5月刊的《今日物理》(Physics Today)杂志上,原作者是大卫·克莱默(David Kramer)。
“科学家们正在利用X射线、电子和中子来破译新型冠状病毒的分子机制并使其失活。”
尽管世界范围内的大多数基础研究已经因为新型冠状病毒的大流行而中止,但有一些实验室仍未关门,并进行着激烈的努力以寻找治疗这种疾病的方法。就这一任务的关键部分而言,物理学家和化学家们发挥着至关重要的作用:他们需要解析出2型严重急性呼吸系统综合征冠状病毒(SARS-CoV-2)的蛋白分子的三维结构,并找出可以锁定和破坏病毒分子机制的位点。在这些实验中并不需要用到整个病毒分子,其主要工作领域仅针对克隆出的病毒蛋白质。
英国的“钻石光源”(Diamond Light Source,这是一台第三代同步辐射装置,能产生超强X射线)产生的射线有一部分是用于进行生命科学研究的,截至2020年4月初,这部分射线已经对外开放,供与SARS-CoV-2有关的研究使用。高级光子源(Advanced Photon Source,APS)实验室的生命科学顾问鲍勃·费斯切蒂(Bob Fischetti)表示,截至本文发稿时,单单是在美国,就至少有23个小组利用阿贡国家实验室的高级光子源开展了相关的研究工作。布鲁克海文国家实验室的国家同步加速器光源二号、斯坦福直线加速器中心(SLAC)的斯坦福同步辐射光源(SSRL)和劳伦斯·伯克利国家实验室的高级光源目前都由数量保持在最低限度的人操作,但每台试验装置都保持开放状态,且其产生的X射线束严格限于用来解析新型冠状病毒几种蛋白质的晶体结构。

上图:位于英国牛津附近的“钻石光源”的鸟瞰图,其研究人员正使用同步加速器来确定新型冠状病毒主要蛋白酶的数十种三维结构,以及与之结合后可能会抑制蛋白酶功能的各种配体,获得的相关信息可用于设计新型抗病毒药物。
位于德国柏林的同步加速器光源二号(BESSY Ⅱ光源)曾短暂关闭,但已于2020年4月2日恢复运行,以协助冠状病毒研究。此类研究也在中国上海的同步加速器上进行着——在中国上海,科研人员解析出了新冠病毒主要蛋白酶蛋白的第一个三维空间结构。位于法国的“欧洲同步加速器辐射装置”已经关闭,以进行升级,但有关方面于2020年4月初宣布,其将根据具体情况,考虑重新开放仪器产生射线束,以进行冠状病毒研究。
新型冠状病毒含有28或29种蛋白质(估计值,确切的数字尚不清楚),在这些蛋白质中,许多蛋白质的结构已经得到了解析,其中既有单独的蛋白质分子,亦有蛋白质分子与其他各种分子(称为“配体”)结合形成的复合物。在那些得到解析的结构中,主要的蛋白酶(Mpro)是一种能够将较长的病毒多肽分解成较短的功能单元的酶。此外,还解析出了一种称为“Nsp15”的核糖核酸内切酶,以及从冠状病毒表面突起,并介导病毒分子侵入人体细胞的刺突蛋白。
截至2020年3月25日,SARS-CoV-2病毒的蛋白质中,已经有108个结构被测定,其中既有被测定的单独的分子结构,也有蛋白质与化合物结合后被测定的复合结构,而且这些信息均已保存在公开的全球蛋白质数据库(PDB)中。当时,英国“钻石光源”的研究团队已经提交了77种结合有各种配体的蛋白酶分子结构。随着时间的推移,越来越多的分子结构被发布出来。
饶是如此,多位科学家警告说,某些已存入数据库的蛋白分子结构的解析工作做得不是很好。“快速和自动化并不总是意味着高质量”,高级光子源的晶体学研究负责人安德烈·乔奇米亚克(Andrzej Joachimiak)这样说道。曼彻斯特大学已退休的生物物理学家、化学家和晶体学家约翰·赫里维尔(John Helliwell)则指出,晶体学家通常会先将解出的结构存入全球蛋白质数据库中,然后再慢慢地进行研究。
对结构生物学家而言,X射线晶体学是迄今为止最常用的揭示蛋白质结构的工具,这种实验手段还能生成迄今为止最高分辨率的结构图像。这一过程通常在低温下进行,以限制电离辐射对蛋白质分子造成的破坏。
在每个同步加速器光源中,小角度X射线散射都需要专用的射线束。这一技术缺乏晶体学的角度分辨率,但可用于检查溶液中的大分子,而且得到的结构接近室温下蛋白质的天然结构状态。X射线散射可以探索病毒的成熟结构如何随着时间的推移而变化。斯坦福同步辐射光源的科学总监布里特·赫德曼(Britt Hedman)表示,这种演变过程可能会持续数小时甚至数天。
◆ ◆ ◆
主要的蛋白酶
当已知晶体的生长条件时(相对于配体结合分析而言),X射线晶体学是确定分子三维空间结构的最快方法,并且可以在几分之一秒的时间内获得衍射数据。通过X射线晶体学而得到的最重要的SARS-CoV-2病毒结构之一就是Mpro蛋白酶。
当病毒RNA进入人体细胞后,会攻击宿主的“蛋白质合成工厂”——核糖体,并以此合成两个长链多肽,其中包含病毒复制所需的成分。有两种蛋白酶可将上述多肽分裂成多个较小的蛋白分子,其中大部分分裂工作是由Mpro蛋白酶进行的。美国橡树岭国家实验室的资深科学家安德烈·科瓦列夫斯基(Andrey Kovalevsky)表示,新冠病毒的Mpro蛋白酶与2003年SARS冠状病毒的Mpro蛋白酶具有96%的相似性,并且这种蛋白酶“对于病毒的复制绝对是至关重要的”。
阿贡国家实验室的高级光子源(APS)可产生16条专门用于蛋白质晶体学研究的射线束,尽管目前还没有全部投入使用。由于世界上其他一些光源实验室已经围绕着Mpro开始了研究,APS的团队便将注意力转向了新冠病毒的其他一些非结构蛋白(NSP)上。由乔奇米亚克领导的APS研究小组于2020年3月2日宣布,对Nsp15蛋白分子的结构进行了解析。乔奇米亚克表示,许多非结构蛋白的功能尚未像Mpro蛋白酶那样得到清楚的理解,但新冠病毒的Nsp15蛋白分子与2003年的SARS病毒中的Nsp15蛋白分子具有89%的相似性,该蛋白分子可能通过干扰人体的免疫反应来提高SARS-CoV-2病毒的致病性。乔奇米亚克领导的研究小组还确定了其他4个非结构蛋白分子的结构。对2003年的SARS病毒的Nsp15蛋白分子的研究表明,抑制该分子能够减慢病毒的复制,尽管目前尚未发现任何药物具有抑制该分子的作用。
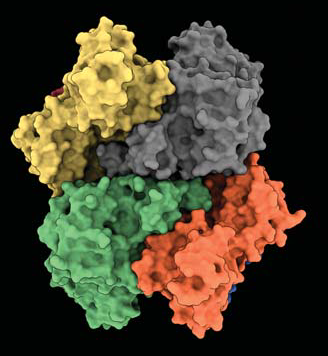
上图:阿贡国家实验室高级光子源(APS)的研究人员解析出了SARS-CoV-2病毒Nsp15蛋白(一种核糖核酸内切酶)的一种分子结构,其由6个相同的肽链组成(上图中只有4个可见)。Nsp15蛋白分子能够切割核糖核酸(RNA)的特定区域,并被认为能够干扰人类的抗病毒免疫机制。从初步的研究结果来看,其他研究小组已经确定了一些可能通过破坏该蛋白质的组装而使其失活的化合物。
由来自美国西北大学、美国普渡大学、美国斯克利普斯研究所(注:其号称是传说中的美国生物医学研究“第一神校”)和沃尔特·里德陆军研究所的研究人员组成的研究团队正在使用APS确定新冠病毒其他3种非结构蛋白和刺突蛋白的结构。截至2020年4月1日,使用APS的科学家已经发现了6种蛋白质的分子结构,他们还发现了这些蛋白质与潜在的抗病毒化合物或抗体相结合的7个结构。APS实验室于2020年3月25日向其15000个用户社区发布了SARS-CoV-2研究计划的可用性通知。费斯切蒂表示,自那时以来,已有25个研究团队收集了数据或申请了射线照射时间。
中国上海的同步加速器也确定了Mpro蛋白酶的分子结构,相关结果于2020年2月4日发布到了全球蛋白质数据库中。由罗尔夫·希尔根费尔德(Rolf Hilgenfeld)领导的吕贝克大学研究团队在BESSY Ⅱ光源上得出了第二种结构,并于2020年2月20日发布到了bioRxiv的预印本服务器上。一周后,“钻石光源”的晶体学家们又提出了第三种结构。每种结构都与之前工作中给出的结构有一致之处,但进行了更进一步的完善。好几个研究团队正在研究“钻石光源”的晶体学家通过Zeno(由欧洲核子研究组织CERN运行的数据存储库)提供的原始衍射数据。“钻石光源”的结构生物学博士后大卫·欧文(David Owen)表示:“世界上每个有能力研究这种蛋白质的团队都会尝试着做到这一点。”
◆ ◆ ◆
从0到1000——在10天之内
“钻石光源”是第一个将工作推进到下一步的研究机构,即快速筛选能与Mpro蛋白酶结合的化合物。在这一被称为“片段筛选”(fragment screening)的过程中,研究人员将蛋白质晶体在溶液中与成百上千的分子量为200~300道尔顿的有机化合物小分子配对,然后,在高通量的过程中对结合的结构进行筛查,以便筛选出有望能作为药物使用的小分子。“在短短10天之内,我们从零开始,筛选出了1000多种晶体结构;到目前为止,我们已经发现60多种小分子能够与Mpro蛋白酶这种蛋白质结合”,欧文这样说道。
与大多数辐射光源实验室一样,“钻石光源”也提供了自动化的晶体学系统,使实验人员可以在家工作并获得数据。操作人员每天只需要加载一次晶体,“钻石光源”每天可以产生数百种蛋白晶体与小分子化合物的组合,并以每小时30种的速度揭示它们的结构。
通过筛选,“你可以了解药物分子的哪些部分起作用,因为你可以查看化合物的片段,并查看这些片段是否单独与蛋白质分子上的结合位点结合”,赫里维尔这样说道。“事实证明,在分子片段中寻找新药是有效的,合成化学家可以利用这些信息,通过有机化学合成的方法将这些分子片段合成在一起。”
每个这种用于生物分子研究的大型辐射光源也都会向一些产业界的用户开放。制药公司和生物技术公司会用其进行专门的研究,但他们也受益于学术界公开提供的结果。“我们为制药公司提供了许多分子结构信息”,欧文说道。“我们已经能够将Mpro蛋白酶的分子结构以非常高的分辨率解析出——精度高于1.3埃米。在这种精度下,可以提供有关每个原子在结构中的位置的非常精确的信息,这对设计药物的人员非常有用。”除其他研究项目外,化学家们还将研究蛋白酶分子与他们构建的小分子之间结合吸引力的强度和紧密性。
2020年3月31日,“钻石光源”宣布,他们与Exscientia公司(英国的一家利用人工智能发现药物的公司)和Calibr(斯克利普斯研究所的药物开发部门)合作,针对现有的几种药物分子进行了筛选——这些药物分子在临床上被证明能够结合到SARS-CoV-2病毒的几种靶蛋白分子上。如果发现这些药物分子对病原体有抑制作用,那么,尽管仍然需要开展人体试验,但这些已获得证明的药物可以加快治疗新冠疾病的进程。

上图:辐射光束资深科学家爱丽丝·杜安格玛特(Alice Douangamath)正在英国的“钻石光源”实验室中检查一种新型冠状病毒蛋白晶体的样品。“钻石光源”的研究人员主要精力集中在新冠病毒的主要蛋白酶Mpro上,这种蛋白质对病毒在人体宿主细胞内的复制至关重要。
Exscientia公司定量药理学研究方面的负责人马丁·雷德黑德(Martin Redhead)在一份声明中表示,Exscientia公司将可以使用斯克利普斯研究所收集的15000种经过批准和经过人体测试的药物,要筛选的靶蛋白分子包括Mpro蛋白酶和刺突蛋白。其他一些制药公司也正在与“钻石光源”展开合作,但一位发言人拒绝透露这些公司的名字。
2020年4月2日,BESSY Ⅱ光源实验室开始针对Mpro蛋白酶进行片段筛选,截至本文发稿时,科学家们正在分析数据。BESSY Ⅱ光源的大分子研究团队主管曼弗雷德·魏斯(Manfred Weiss)表示:“我们从150万种可购买到的化合物开始,所谓‘可购买到’是指至少可以买到1毫克。”“我们根据分子量大小、溶解度和药物化学家提出的一些规则,对这些化合物进行了‘过滤’。”最终,约有1200种化合物符合标准。魏斯表示,典型的片段筛选会产生10~12种结合的化合物,这可以作为药物研究的起点。他还补充说,“片段”这一术语具有误导性,因为分子实际上并不是任何东西的片段。
工业高分子晶体学协会-协作访问团队(IMCA-CAT,注:这实际上是一个专注于药物研发的结构生物学研究机构)的执行董事丽莎·基夫(Lisa Keefe)表示,工业界已经开始进行片段筛选。IMCA-CAT是一个由行业资助的非营利性协会,与学术界不同,它在使用APS提供的辐射光束时需要付费。IMCA-CAT成立于1992年,其加入资格仅限于默克、辉瑞、百时美施贵宝、诺华和艾伯维等大型工业制药公司。非会员公司也可以被安排使用IMCA-CAT的辐射光束。公司用户可以对其自己发现的数量庞大的分子片段进行筛选,而不必将结果公开。基夫表示,她不会透露正在进行药物分子筛选的公司名称或他们所研究的蛋白质分子,但她同时也指出,在当前的这场疫情危机中,“会员之间存在若干联系”,以便对研究结果进行比较。
大多数学术研究人员无法访问这些大型制药工业公司的化合物数据库,魏斯对这一点感到遗憾。不过,结构基因组学联盟(Structural Genomics Consortium,SGC,该联盟是一个兼具公共和私立性质的国际非营利组织)的负责人艾丽德·爱德华兹(Aled Edwards)表示,公开的和公司私有的化合物分子数据库之间的区别并不大。他声称:“没有证据表明其中一者比另一者要好得多。”
◆ ◆ ◆
电子与中子
除了晶体学方法之外,其他几种技术也被用于蛋白质分子结构的测定。对于某些存在结晶抗性的分子,例如大型蛋白质复合物,研究人员可以求助于低温电子显微镜(cryo-EM,也称“冷冻电镜”)。由美国德克萨斯大学奥斯汀分校的杰森·麦克莱伦(Jason McLellan)领导的研究小组使用该技术确定了新冠病毒分子刺突蛋白的结构,相关结果于2020年3月13日发表在了《科学》杂志上。刺突蛋白被认为是疫苗作用靶点的主要候选分子,不过,由于刺突蛋白的基底部锚定在疏水性的病毒包膜上,而蛋白分子的其余部分是亲水性的,因此全长度的刺突蛋白质分子很难结晶。
斯坦福大学的直线加速器中心里有6台低温电子显微镜,斯坦福大学专门将其中的1台对外开放,用于SARS-CoV-2病毒的研究。“钻石光源”实验室里有5台可用的低温电子显微镜,其专门将当中的1台留给工业界使用。
正如X射线晶体衍射技术一样,利用冷冻电镜技术,排列方式各种各样的分子有助于最终结构的确定,这是因为,虽然在晶体内部分子的排列方式是相同的,但用冷冻电镜观察时,超低温冷台(温度可低至零下185摄氏度)上的分子的排列方向是随机的,分子越多,越能通过单个的二维投影图像通过统计计算等方式组合成一个清晰的三维图像。
斯坦福直线加速器中心的冷冻电镜和生物成像部门负责人赵华(Wah Chiu)表示,在理想的条件下,分子可以被良好地保存在电子显微镜的支撑网格上,大约需要10个小时的时间才能收集到足够多的数据以生成具有原子细节的分子结构。较困难的情况下,可能需要48小时或更长的时间。冷冻电镜技术可以用于对玻璃态细胞的薄区域成像,并生成三维断层图,从中可以分辨出成熟的病毒颗粒。
除了研究非结晶分子之外,通过与先进的图像处理技术相结合,冷冻电镜技术还可以从单个样品中获得多种蛋白质的空间构象。该方法可观察到不同生化和功能条件下蛋白质分子的动力学特性。赵华表示,冷冻电镜的一种新兴用途是揭示正常和病理条件下原位细胞结构(即细胞结构在细胞内的原始位置)的整体构造。
在蛋白质分子的三维晶体结构中是看不见氢原子的,这一特性非常重要,因为蛋白质分子上最强的结合位点大都与氢键有关。在X射线晶体学中,光子在组成蛋白质分子的各个原子形成的电子云中发生散射。作为最轻的元素,氢原子对X射线的散射极弱,因此,X射线晶体学专家通常只能推断分子结构中氢原子的位置,尤其是在酶反应中,因为此类反应经常涉及一些可电离的氨基酸。相反,中子与原子核的相互作用可提供明显的氢原子特征,其强度与蛋白质分子中的氮原子、氧原子和碳原子相当。
法国劳厄-朗之万研究所(ILL)中子源实验室的化学家兼晶体学家马修·布莱克利(Matthew Blakeley)指出,X射线在穿过晶体时会产生破坏分子结构的自由基,为了限制自由基的扩散,通常需要在100开尔文的温度下收集X射线数据。相比之下,中子不会破坏蛋白质样品,因此可以在室温下使用中子进行晶体学研究。不利的一点是,根据科瓦列夫斯基的说法,中子束的强度要比X射线小好几个数量级,因此收集结构数据可能要花7~10天的时间,这导致中子束技术不太适合用于分子片段筛选。此外,使用中子束技术还需要更大的晶体,而较大的晶体是很难生长出来的。
美国橡树岭国家实验室于2020年4月7日重新开放了其散裂中子源,并优先用于针对SARS-CoV-2病毒的研究。该实验室的另一个中子源(高通量同位素反应堆,HFIR)原定于2020年4月27日恢复运行,对新冠病毒的研究将获得使用这两处中子源产生的射线束的优先权。在之前新冠疫情大流行刚开始时,这两处设施都已关闭,以进行例行的定期维护。劳厄-朗之万研究所的中子源仍处于关闭状态,并且尚未确定重新开放的日期。
尽管X射线自由电子激光器(XFEL)对研究SARS-CoV-2病毒可能非常有用,但截至2020年4月初,斯坦福大学的直线加速器相干光源(LCLS)和位于德国的欧洲X射线自由电子激光器都已“下线”:LCLS已关闭以进行升级,但斯坦福直线加速器实验室的发言人表示,在取消加利福尼亚州的“就地隔离”命令后,可能很快就会重启;欧洲X射线自由电子激光器的团队负责人伯恩德·埃伯林(Bernd Ebeling)在一封电子邮件中表示,一旦能够重新运行,该设备产生的射线将专门用于新型冠状病毒研究。截至本文发稿时,尚不清楚日本的SACLA(目前世界上唯二的X射线自由电子激光器,另一个就是德国的XFEL)是否在进行新冠病毒研究。
赫里维尔表示,与同步加速器相比,X射线自由电子激光器有两个优点:一是它们可以在室温下确定分子结构;二是其飞秒级的脉冲长度和较高的射线强度可以在辐射破坏蛋白质分子的结构之前就收集到衍射数据——辐射损伤会改变蛋白质分子的结构,从而影响对蛋白质分子功能的分析和阐释。
鉴于这些优点,因此X射线自由电子激光器可以获得亚微米级精度的晶体分子结构信息。德国汉堡大学的拉尔斯·雷德克(Lars Redecke)领导的一个研究小组在2012年使用LCLS报告了第一个用XFEL解决的新生物分子结构。
◆ ◆ ◆
后续的需求
尽管研究的速度非常快,但许多科学家仍然怀疑能够抵抗新冠病毒的药物或疫苗是否能及时问世以缓解目前的大流行。人体试验可能还需要一年甚至更长的时间,即使对于已发现对新冠病毒具有一定作用的、已批准的药物或抗体也是如此。最近出台的药用化合物的时间表甚至更长。结构基因组学联盟的负责人爱德华兹表示:“同步加速器和冷冻电镜都不会对这一波大流行产生重大影响,但是,这两者都将成为使科学界做好准备预防下一波暴发性流行的真正的有力工具。”
阿贡国家实验室高级光子源的总监斯蒂芬·斯特雷弗(Stephen Streiffer)对此表示异议。他认为,任何已获批准的、对人类有用的现有化合物,如果被发现具有治疗作用,那么都将立刻被投入到临床使用之中。他指出,当前的公共卫生策略旨在延缓感染的传播,直到疫苗问世并可以实际应用为止。
乔奇米亚克对SARS病毒和MERS病毒(被认为是2012年出现的“中东呼吸综合征”的病原体)的药物研发方面缺乏后续工作表示遗憾。他表示:“美国国立卫生研究院(NIH)在过去20年里花费了7亿美元去研究SARS和MERS病毒,可我们却没有开发出抗病毒药物,没有研发出抗体,也没有针对SARS和MERS的疫苗。”他还指出,为应对早期疫情而开发的药物可能已经对当前的病原体产生了作用。
— THE END —

