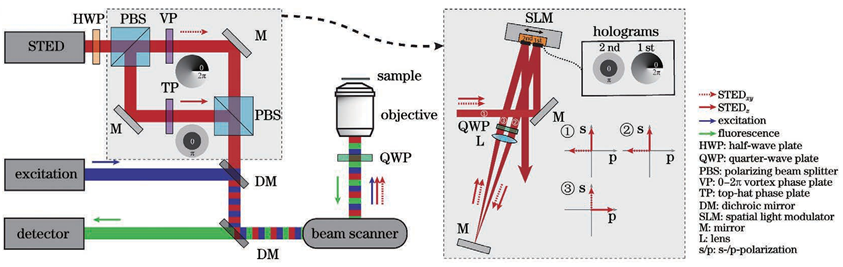
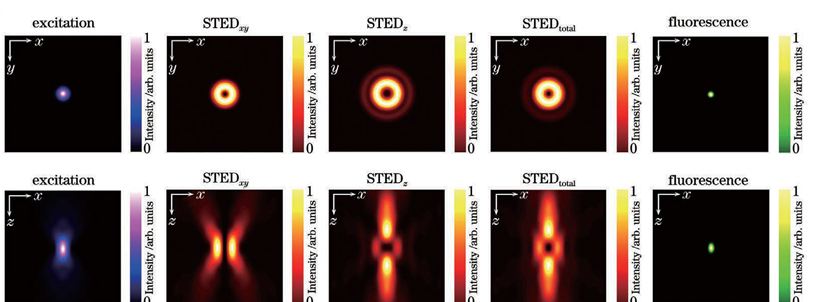
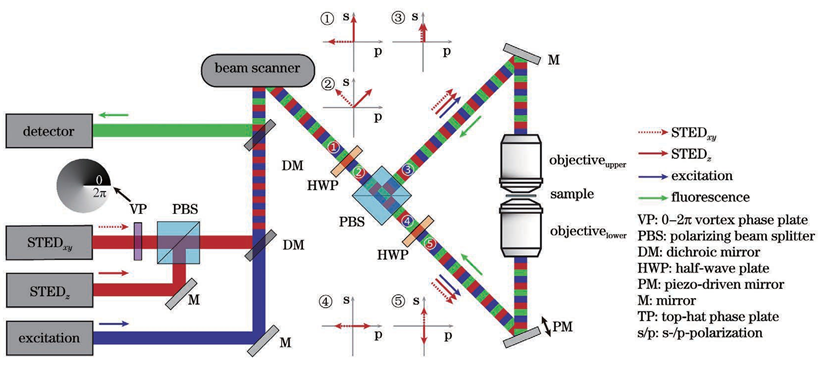
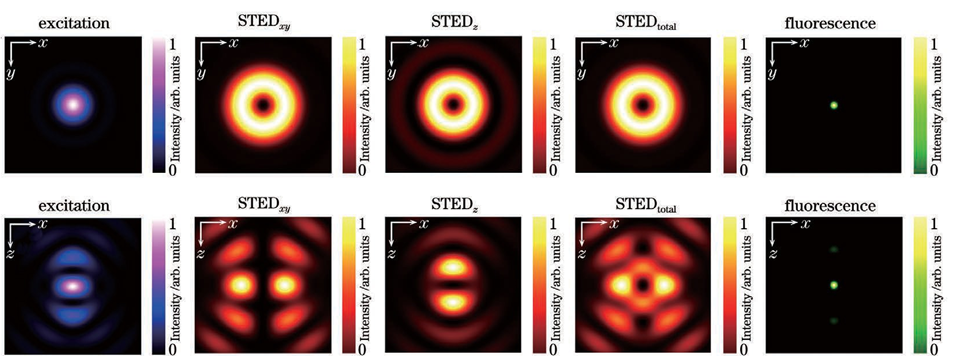
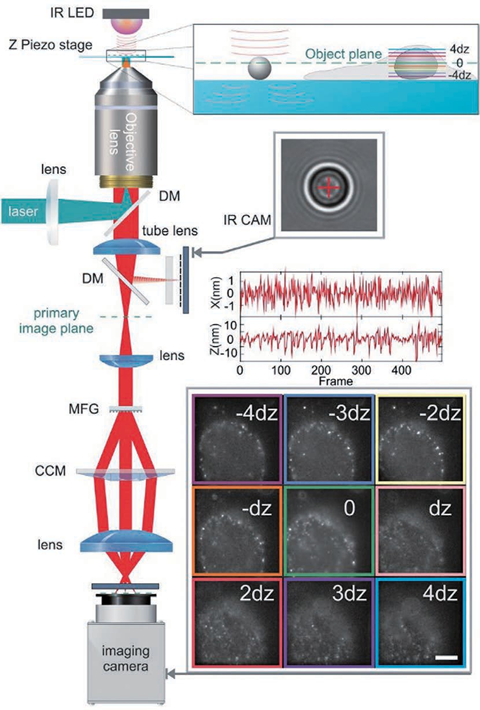
传统光学显微成像技术能够清晰分辨出三维亚细胞结构,这对细胞生物学研究来说是必不可少的。然而由于阿贝衍射极限的存在,传统光学显微镜的分辨率受到了限制。在可见光波段,传统光学显微镜的横向分辨率仅为200~300nm,轴向分辨率为横向分辨率的1/3~1/2,只能达到500~800nm。显然,这两个尺寸都远大于许多亚细胞结构。于是,科学家们基于物理和化学方法提出了许多突破光学衍射极限的显微成像技术。在众多技术中,基于荧光标记的超分辨显微成像技术将横向分辨率和轴向分辨率分别提高了至少10倍和6倍,一跃成为当下的研究热点。荧光显微成像技术都是通过荧光团的亮态(on state)和暗态(off state),按时间顺序记录其亚衍射极限特性,并且荧光分子处于亮态或暗态的概率与激发光强呈非线性相关。通过对荧光团进行坐标定向或者随机时间开关处理,荧光显微镜就能够在亚衍射极限范围内清晰地分辨出荧光标记的细胞结构,实现了从传统光学显微镜到超分辨光学显微镜的转变。通过此原理,科学家们也首次通过荧光显微镜进行了许多基本的生物学研究。目前,超分辨显微成像主要分为三种技术:第一种技术以受激辐射损耗 (STED)显微术为代表。STED采用两束激光,一束用于激发荧光分子产生荧光,另一束中心光强为零的环形损耗光用于损耗荧光并将发光区域限制在衍射极限以下,于是通过点扫描的方式即可实现超分辨成像。第二种技术以单分子定位显微术(SMLM)为主,其代表性技术有光激活定位显微镜(PALM)和随机光学重构显微镜(STORM)。SMLM 通过使用激活光和激发光控制成像区域中每次成像时仅有少量、随机、离散的荧光分子发光,再通过高斯拟合得到每个荧光分子高精度的空间定位,最后将所有图片进行叠加,形成一幅超分辨图像。第三种技术是结构光照明显微术(SIM)。SIM 通过使用具有空间结构的光束将空间高频成分编码到荧光图像,再通过图像算法解码重构出超分辨图像。理论上,SIM 的分辨率极限为传统光学显微术的两倍,而 STED 技术和 SMLM 的分辨率没有限制。在受激辐射损耗显微成像中,中心光强为零的环形暗斑可以用来提高横向分辨率,但由于轴向上并不能损耗荧光,轴向分辨率并未得到提升。此外,由于像差的存在,成像的深度也受限。因此,在三维成像中,提高轴向分辨率、增大成像深度、实现具有各向同性三维分辨率的深度成像至关重要。根据STED的成像原理,要想提升显微成像系统的三维空间分辨率,实现样品的三维超分辨成像,关键是要让损耗光在样品焦平面处聚焦成一个三维中空暗斑,只有暗斑中心所在位置可以发出荧光,其他位置的荧光都被损耗了。要想实现这一点,目前的技术主要有基于单物镜架构的3D-STED 和基于双物镜架构的isoSTED。基于单物镜架构的3D-STED 的技术关键是对损耗光加载0/π环形相位(也叫作“Top-hat”相位),这种相位分布可以让损耗光经过物镜聚焦成具有焦面中心强度最小、焦面上下强度最大分布的三维暗斑。在这种架构(z-STED)下,基于单物镜架构的3D-STED 技术相比于共聚焦显微成像技术,可以获得轴向6倍和横向2倍的分辨率提升,即获得90~110nm的近乎各向同性的三维分辨率。为了进一步增大横向的损耗、提升横向分辨率,可以通过再引入一路损耗光加载传统的0~2π涡旋相位,产生一个横向分布的“甜甜圈”形状的环形暗斑,最终将两个暗斑在焦面进行非相干强度叠加,得到横向43nm和轴向125nm的分辨率。图1:基于单物镜架构的3D-STED纳米显微技术原理图如图1所示,损耗光经过偏振分束器后分为水平偏振光STEDxy和垂直偏振光 STEDz,分别加载0~2π涡旋相位板和0/π环形相位板,二者随后经过偏振分束器合束,接着与激发光通过二色镜合束,最终经过光束扫描组件和1/4波片一起进入物镜。值得注意的是,为了保证两束损耗光的非相干性并形成高质量的三维暗斑,两束损耗光脉冲在时间上有一定的延迟。除了可以使用相位板对损耗光进行波前调制,也可以利用空间光调制器(SLM)对其进行波前调制。相位型的液晶空间光调制器往往只能对一种偏振光进行调制,这种偏振光的偏振方向与液晶取向一致。图1展示了这样的一种架构:空间光调制器只对水平偏振光进行调制,其加载的第一个全息图是0~2π涡旋相位,相位的第二个全息图是0/π环形相位;水平偏振光STEDxy和垂直偏振光 STEDz,经SLM第一个全息图的调制后,只有损耗光STEDxy受到调制;两束损耗光随后依次经过1/4波片、透镜,再经反射镜原路返回经过透镜、1/4波片,此时原来的垂直偏振光STEDz已经变成水平偏振光,受到SLM 第二个全息图的调制,而原来的水平偏振光STEDxy已经变成垂直偏振光,不再被SLM 调制。通过调节两束损耗光的光强比,可以分别调节横向和纵向的损耗能力,最终可以得到不同形状的荧光点扩展函数(PSF)。图2展示了3D-STED 技术中激发光、损耗光和荧光 PSF在xy 和xz平面的强度分布。值得注意的是,SLM的表面要和物镜后焦面光学共轭。此外,利用SLM 还可以很方便地对暗斑的形状及位置进行控制,例如:可以通过泽尼克系数对损耗光波前进行补偿,达到像差校正的目的;可以随时切换到二维 STED模式 (两个全息图都加载0~2π 涡旋相位);可以调节全息图的大小以及环形相位的直径以匹配不同的物镜;可以通过加载光栅相位实现和激发光的自动对准。基于双物镜架构的isoSTED 的技术关键是损耗光通过两个对置物镜在样品面发生干涉而形成暗斑。采用两个对置物镜的4Pi显微镜,对荧光样品进行双向激发和双向探测,等效于在轴向上增大了物镜的孔径(得到近乎4π的空间立体角),这样可以减小PSF 的轴向大小,极大地提升轴向分辨率。2002年,研究人员首次将 STED 与 4Pi技术相结合,获得了33nm 的轴向分辨率。在这种被称为“STED-4Pi”的显微镜中,通过对STED 光引入像差来消除聚焦暗斑除中心以外的其他极小值,从而消除荧光PSF沿轴向分布的旁瓣。进一步地,2008年研究人员提出的isoSTED 技术可以在此架构下提升横向分辨率,得到 40~45nm 的各向同性分辨率。isoSTED 的光学装置简化示意图如图3所示,一束损耗光STEDxy通过0~2π涡旋相位板后经偏振分束器分为两路,二者分别进入两个对置物镜,在样品面发生相长干涉,形成一个横向分布的暗斑,产生横向上的荧光损耗。另一束损耗光STEDz经偏振分束器后分为两路,二者分别进入两个对置物镜,在样品面发生相消干涉,形成一个纵向分布的暗斑,产生纵向上的荧光损耗。最终,这两个暗斑在样品面进行非相干强度叠加,生成一个三维中空暗斑,如图4所示。通过调节STEDxy和STEDz的光强比,最终可以得到一个近乎球形的荧光PSF。值得注意的是,为了避免这两个暗斑在样品面相互干涉、影响三维中空暗斑质量,STEDxy和STEDz这两束损耗光通常由两台激光器分别产生;此外,最终生成的三维中空暗斑在焦面上下有零值暗斑,使得此处的荧光不会被损耗掉,最终荧光PSF 在焦面上下会有两个旁瓣,形成伪像,这个旁瓣可以在后期通过线性或非线性反卷积算法消除;另外,由于像差随着深度的增加而增大,该技术只能成像深度在1μm 以内的样品。2020 年,研究人员将自适应光学技术用于isoSTED系统(AO isoSTED),以三维亚50nm 的分辨率对全细胞和组织样品进行成像。AO isoSTED 技术和2008 年研究人员提出的isoSTED技术相比,有如下三方面的改进:1) STEDxy和STEDz来自同一激光器的不同偏振成分,并采用迈克耳孙干涉仪装置对两束光进行脉冲延迟以破坏其相干性,同时利用一个SLM对两束光分别进行相位调制,对STEDz加载离焦相位,以有效地消除荧光PSF在焦面上下的旁瓣;2)在原来的两条干涉臂各放入一片1/4波片,使得激光在进入物镜前由原来的线偏光转为圆偏光,这样可以降低激光对荧光分子选择性激发与损耗的概率,同时减小图像中激光导致的背景;3)在原来的两条干涉臂各放入一个变形镜,采用无传感自适应光学技术对像差进行校正。值得注意的是,尽管isoSTED技术实现了厚样品成像,其三维分辨率也高于3D-STED技术,但是由于双物镜的对准要求极为严苛,其仍面临系统复杂、搭建调试难度大的问题。2016年,考虑到4Pi系统的高度轴向对称性,北京大学Yang等提出镜面增强超分辨显微技术( MEANS),用一面反射镜取代样品后面的载玻片,使得入射光和反射光在镜面发生干涉,得到轴向110nm的分辨率,其与二维STED技术相结合( MEANS- STED),可以在STED的基础上进一步将横向分辨率提升2倍,获得19nm的横向分辨率,但是其成像深度仅在离镜面200nm范围内。总的来说,使用单物镜的镜面增强超分辨显微技术降低了iSoSTED技术的系统复杂度。上述技术旨在通过缩小荧光发光区域即减小荧光PSF体积来提升成像时的三维分辨率。而膨胀显微技术(ExSTED)首先通过化学手段对样品进行各向同性的物理膨胀,然后进行成像,这样三维分辨率得到提升,且提升的倍数与膨胀的倍数相当。进一步地, ExSTED技术结合了样品膨胀显微技术和STED超分辨显微技术,可以得到亚10nm的二维分辨率和亚50nm的三维分辨率。值得注意的是,亚50nm的三维分辨率是采用水镜得到的,这样做是为了得到更大的成像深度,但如果采用油镜的话,可以进一步提升三维分辨率,但折射率不匹配引起的球差会使得成像深度受限。在三维成像应用中,保持在不同深度处有较高的三维分辨率是很有必要的。成像深度往往受限于成像过程中的光散射和像差。此外,光散射和像差也会影响STED成像中激发光和损耗光的对准以及三维暗斑的质量。为了减小成像过程中的光散射和像差,增大三维成像深度,主要从选择合适物镜、采用样品清洁技术和使用自适应光学技术这三个方面进行考虑。在进行厚样品的深度成像时,物镜浸没液和组织样品的折射率不匹配会导致球差的产生,且球差随着成像深度的增加而增加。虽然高折射率的浸没液会让物镜拥有更大的数值孔径,集光能力更强,理论上会带来更高的成像分辨率,但是其和样品折射率不匹配而导致的球差会降低成像质量。因此,针对不同的组织样品,选择合适的物镜浸没液至关重要。在对富含脂质的脑组织切片进行成像时,由于其折射率更接近甘油(折射率1.45)而不是水(折射率1.33),因此选择甘油物镜更合适。此外,额外的校正环可以进一步补偿折射率不匹配问题。2011年,研究人员使用带校正环的甘油物镜,对活脑切片进行成像,以二维60~80nm的分辨率揭示了突触内的肌动蛋白分布,成像深度可达120μm。在对活细胞成像时,由于其折射率更接近水(折射率1.33)而不是油(折射率1.518),因此,选择水镜更为合适。此外,额外的自适应光学元件,如空间光调制器,可以对损耗光的暗斑进行球差校正。2018年,研究人员利用水镜,结合空间光调制器,在z-STED架构下实现对活细胞样品的成像,轴向成像深度可达37μm,轴向分辨率可达150nm,对充满水的荧光珠成像时穿透深度可达180μm。在对膨胀样品进行成像时,由于样品存在于吸水膨胀后的凝胶之中,凝胶由水构成,其折射率为1.33,因此选择水镜更为合适。2018年研究人员等在ExSTED中,选用NA为1.2的水镜后成像深度由使用油镜时的不到5μm增大到50μm,并获得70nm的三维分辨率。使用自适应光学技术可以进一步校正由样品折射率变化导致的像差。自适应光学技术通过动态校正元件(如空间光调制器和变形镜),采用特定的像差测量技术和控制方法(如直接波前测量和间接像差优化)来补偿畸变的波前,提高成像质量。将自适应光学技术用于STED 显微术时,空间光调制相比于变形镜对光的偏振和波长敏感,因此常将其放置于损耗路,用来调制损耗光,而变形镜常被放置于激发光、损耗光和荧光共同所在的光路,用来调制所有光束。值得注意的是,为了保证调制效果,空间光调制器和变形镜需要和物镜后焦面呈光学共轭。一种测量像差的方法是通过波前传感器(如 Shack-Hartmann波前传感器)来直接进行测量,但这种方法往往需要一个点状的荧光目标作为“导星”;另一种测量像差的方法是通过间接进行像差优化,按照一定的控制模式(如泽尼克系数)不断改变动态校正元件的相位分布,获取一系列图像,并对每一幅图像进行像质评价(如图像总强度或锐度),从而确定最佳的相位分布;此外,还可以通过测量不同深度的焦斑图像,利用相位恢复算法,得到畸变的波前分布。此外,将中空贝塞尔光束作为损耗光、高斯光束作为激发光的GB-STED 技术,充分利用中空贝塞尔光束的非衍射和自重构特性,可以在类似脑组织灰质的样品约100μm 深度处成像,横向分辨率约为100nm。
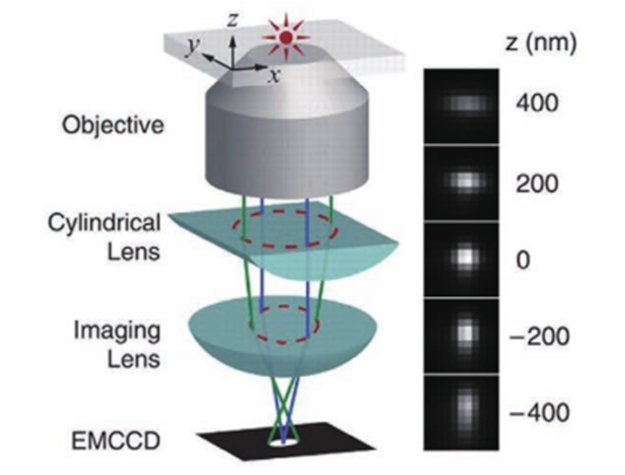
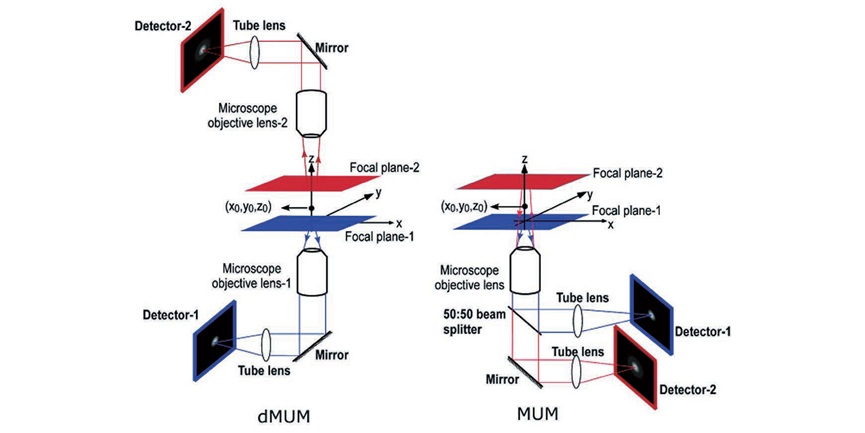
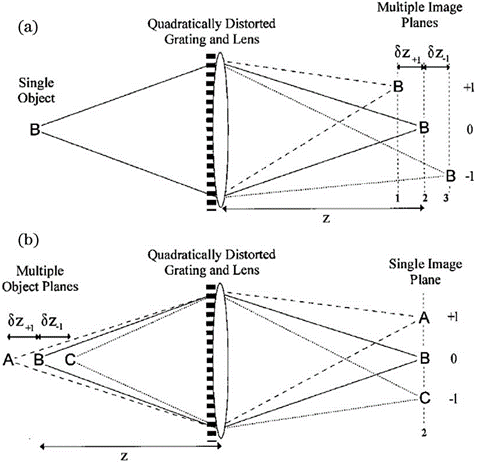
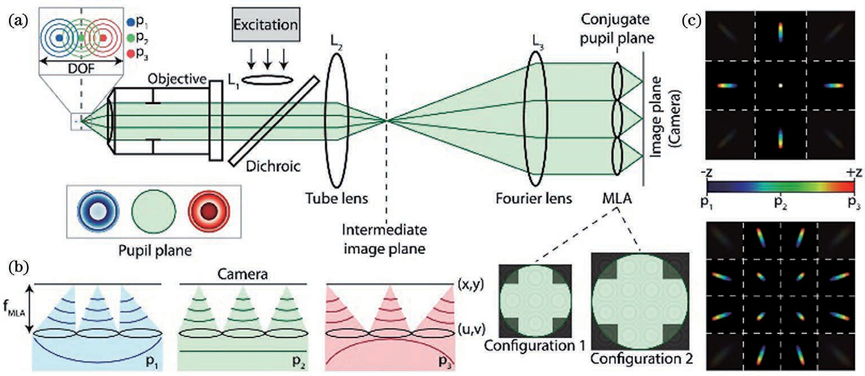
在单分子定位显微成像中,荧光分子的横向位置可以根据其图像中类高斯分布的质心确定。可是对于轴向定位,虽然可以通过离焦的光斑大小进行轴向定位,但是无像差的 PSF 关于焦平面对称,这使得 PSF 在焦平面两侧距离相同的位置处是相同的,无法确定离焦方向。除此之外,PSF的轴向位置变化灵敏度较低、离焦信号信噪比较低、定位深度依赖于系统景深等问题也亟须解决。图5为无像差的PSF 在不同轴向位置的图像。于是,人们提出了多种三维成像技术来提高SMLM 的轴向分辨能力、增大成像深度,例如 PSF工程、多位置观测、超临界角荧光和4Pi显微镜等其他方法。由于无像差的PSF在焦平面两侧是具有对称性的,那么可以人为改变PSF的空间分布,将PSF的轴向位置信息编码到PSF的横向形状上,并通过横向形状进行轴向定位。这类方法被统称为PSF工程。由于无像差的PSF在焦平面两侧具有对称性,那么在PSF中引入不具有对称性的像差就可以打破这种局面,实现轴向定位。早在1994年,研究人员通过在PSF中引入像散,实现了单个荧光颗粒的三维示踪(SPT),轴向分辨率可达12nm。基于此技术,2008年研究人员实现了3D-STORM。如图6所示,在传统的荧光成像光路中,他们在物镜( objective)和筒镜( imaging lens)之间加入了一个焦距为1m的柱透镜( cylindrical lens)使得图像在x和y方向受到不同程度的调制。于是,荧光分子的PSF椭圆度和方向随着轴向位置的变化而变化。当荧光分子恰好在平均焦平面时,PSF在x和y方向上具有相等的宽度,图像呈圆形;当荧光分子在其他位置时,PSF在x和y方向上聚焦程度不同,图像呈椭圆形。因此,如果标定好PSF在x和y方向上宽度关于z的变化曲线(校正曲线),那么只需要测量PSF在这两个方向上的宽度就可以确定荧光分子的轴向位置。在绘制校正曲线时,首先使量子点或荧光分子稀疏地附着在盖玻片表面,保持样品台不动,在z方向移动物镜以恒定速率进行扫描,得到不同轴向位置的PSF。然后使用二维椭圆高斯函数进行拟合,得到PSF中心坐标以及x和y方向的宽度。使用离焦函数进行拟合,并对折射率不匹配进行修正,最终可以得到校正曲线。由于柱透镋改变了PSF的形状,横向拟合误差增大,x和y方向的分辨率大致为20~30nm,略低于传统2DSTORM。x方向的分辨率大致为50~70nm,约为x和y方向的2~3倍。此方法光路较为简单,成本低,是目前最受欢迎的方法。当然,引入像散的缺点也很明显。单次成像的定位深度较浅,通常限制在距离平均焦平面±350nm的范围,要对厚生物样品进行成像依赖于轴向扫描,因为距离基准面越远,PSF逐渐展宽,信噪比会变低。并且,样品和物镜之间折射率的不匹配会产生球差,这使得在距离基准面越远位置的球差影响越大。但是值得注意的是,在基准面以下,球差影响较小。另外,选择柱透镜的焦距时,需要在像散强度和信噪比之间进行权衡,像散越强,横向PSF对于轴向位置变化的分辨率就会越高,具有深度信息的横向PSF对轴向位置变化的灵敏度就会越高,但是信噪比也会越低。若想同时保证信噪比和轴向成像深度,可以使用双物镜,2012年研究人员在此系统的基础上,将单物镜改为双物镜,光子利用效率提升了两倍,单分子定位精度在横向和轴向分别为4nm和8nm。在对肌动蛋白丝进2018年研究人员提出了自干涉三维超分辨显微镜(SELFI)。SELFI的原理如下:对于焦点平面附近的荧光分子,所收集的荧光的波前曲率很大程度上取决于分子的轴向位置,并且在焦点处表现出曲率符号反转。因此,在成像平面中,通过干涉测量对荧光波前进行分析,可以得到荧光分子的轴向位置。他们通过在距离像面几微米的位置处加入一个相位衍射光栅对PSF 进行改进,产生了一种空间重叠度大于90%的自相干PSF,它的干涉图案随着荧光分子的轴向位置的变化而改变,并且干涉图案的包络线对应着原始PSF的横向分布。因此,根据干涉图案就可以进行三维定位。而且,SELFI对像差不敏感,可以让3D MLM 深入完整组织内部进行三维成像。于是,他们把SELFI与像散技术进行了比较,结果表明在成像深度大于10μm 时,像散技术的轴向定位精度明显下降,但是SELFI依旧保持着各向同性的定位精度。随后,他们使用SELFI对厚样品中肌动蛋白和 OCT4 进行三维成像,其中在对 OCT4进行成像时,SELFI揭示了OCT4在未清除的组织球体内部深达50μm 的空间分布,这也证明了SELFI具有对厚样品进行三维成像的能力。2019年他们实现了 SELFI的活细胞三维成像。当然,SELFI的轴向定位深度相比于像散技术并没有很大提升,可以实现700nm(±350nm)深度下的轴向定位。为了解决成像深度较浅的问题,2009 年 研究人员报道了一种使用双螺旋PSF(DH-PSF)进行三维成像的技术。如图7所示,在4f 系统中,他们使用SLM 在傅里叶面对 PSF 进行调制,通过在模态平面叠加特定的高斯-拉盖尔模式,使PSF 拥有类似于DNA 的双螺旋结构。在距离焦平面不同深度的位置上,DH-PSF 两个主瓣之间连线与水平方向夹角的不同,反映了荧光分子轴向位置的变化。与像散的方法一样,在绘制校正曲线后,就可以确定荧光分子的轴向位置。对于单颗粒成像,这种方法的成像深度可以达到2μm,三个方向的分辨率都可以达到10~20nm,并且使用最大似然估计法时,分辨率还可以继续提高。但是 DH-PSF 旁瓣(side lobes)的能量占用和SLM 的能量损失,导致光子利用效率较低,需要较长的曝光时间才能提高定位精度,因此这种方法只适用于高亮度的荧光染料和荧光蛋白。若想要减少SLM 的能量损失并对细胞结构进行成像,则可以使用专门定制的相位板(phase mask)代替 SLM,DH-PSF 被广泛地用于生物样品(如微管)的成像,其横向和轴向分辨率分别能达到20nm和30nm,成像深度最大可以达到2.5μm。后来,人们基于理论或者实验调制出了多种PSF,用于增大成像深度、提高定位精度,例如:phase ramp PSF、corkscrew PSF、self-bending PSF、saddle-point PSF、tetrapod PSFs、 bisected PSF、Airy-beam PSF和 twin-Airy PSF等。PSF 的横向尺寸在焦平面附近变化缓慢,仅凭单独的2D PSF 拟合很难确定其轴向位置。因此,除了采用 PSF 工程修改 PSF 形状,也可以通过在物方或者像方的不同位置进行同时成像,从中提取物体的轴向位置。如图7所示的多焦面显微镜(MUM)和双物镜多焦面显微镜(dMUM),用于提升三维成像的轴向分辨能力。对于 MUM,当两个探测器分别位于焦平面(0nm)和远离焦平面(500nm)的位置时,对于同一个分子发出的荧光信号,探测器接收到的信号强度是不同的,换而言之就是横向PSF 的形状不同。因此,可以通过实验测得深度和PSF 形状(信号强度分布)之间的关系,确定荧光分子的轴向位置,或者可以通过 PSF 模型的理论计算进行定位。相对于传统显微镜,MUM 提升了焦平面附近的定位精度,为增大定位深度,可以继续增加平面个数、增大间距,但是每个探测器分配到的光子数也会减少,导致定位精度下降,因此通常将 MUM 和其他方法相结合以弥补不足,例如艾里光束 PSF。dMUM 使用了类似于 4Pi 和I5M的双物镜结构,提高了光子利用效率,定位精度得到进一步提升,在SPT 中的轴向定位精度最高可以达到10nm 左右,定位深度可达1~2μm。但是相比于 MUM,dMUM 的系统复杂度较高。另外需要注意的是,MUM 和 dMUM 都存在着一个问题,对于NA较大的物镜,对偏离物镜和管镜预设的焦平面进行成像会引入球差和其他高级像差,影响定位精度,并且在偏移较大的情况下像差的影响会加重。为减小多平面观测中像差的影响,可以使用定制的衍射光学器件将物体发出的光衍射为多个级次,并同时无像差地成像在同一平面的不同位置上,不同级次衍射光的相位不同,对应着不同位置的平面,如图8所示。一种像差校正的多焦点显微镜(MFM),设计了一种多焦点衍射光栅,将荧光衍射为9个级次,即得到了9 个间距相同的平面。使用 MFM 对 RNA聚合酶II的异质核迁移进行三维示踪,单次成像深度可以达到 4μm。相比于dMUM使用双物镜和MUM使用多个分束镜产生多个平面的方法,MFM的系统较为简单,只需在4f系统的傅里叶面加入多焦点衍射光栅即可。2014年研究人员将MFM(图9)应用于 STORM/PALM中,实现了多色3 D SMLM全细胞成像。他们对哺乳动物线粒体网络和酵母微管进行了成像,单次成像的定位深度可达4μm,横向和轴向分辨率分别为20nm和50nm。但是,多焦点衍射光栅的衍射效率较低,9个级次的理论极限仅为67%左右,想要提高光子利用效率,可以增加衍射级次或者使用多重相位光栅代替原本的二元光栅,从而可将9个级次的光子利用效率提升至74%,甚至更高。由上可知,想要增大单次成像的定位深度,最直接的办法就是增加平面个数。但是,这也需要在定位精度和平面个数之间权衡,平面个数的增多会让每个平面分配到的光子数减少,导致每个平面的定位精度降低。换而言之,位于特定平面上的荧光分子是这些图像中某个子集的焦点,同时在其他荧光分子进行定位时荧光分子又是背景噪声,用于提升定位精度的光子个数仅占探测到总光子数的小部分。因此,双/多平面技术直接应用于细胞结构的3 D SMLM成像具有一定难度,因此多平面技术也通常和其他技术(如像散)进行结合并且也在3D SPT成像中应用广泛。另一种实现在不同位置同时观测的方法就是多角度观测,此方法通常表现为在样品基底加入微反射镜、增加视场角或成像光路引入视差。2009年,研究人员次使用锥形微反射镜孔基底对直径为190nm 的聚苯乙烯颗粒进行高速3D SPT 成像,三维定位精度达到了20nm。如图10所示,当颗粒发生轴向移动时,虽然其不影响对颗粒的直接成像,但是荧光在微型反射镜的入射点是上下移动的,使得颗粒的反射成像在横向上移动,即微型反射镜将轴向位移转化为横向位移,并且结合其他位置的反射成像实现轴向定位。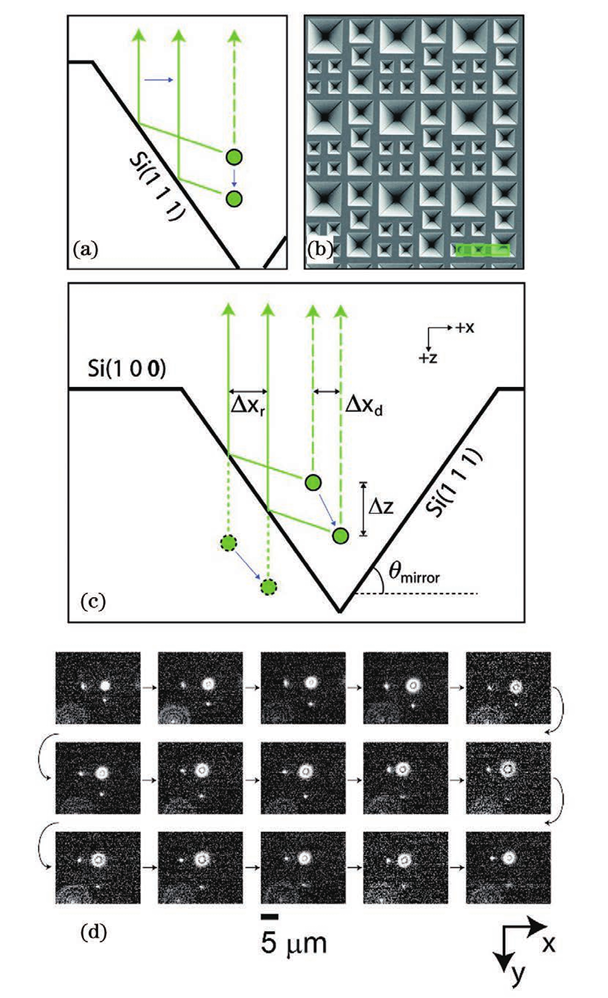
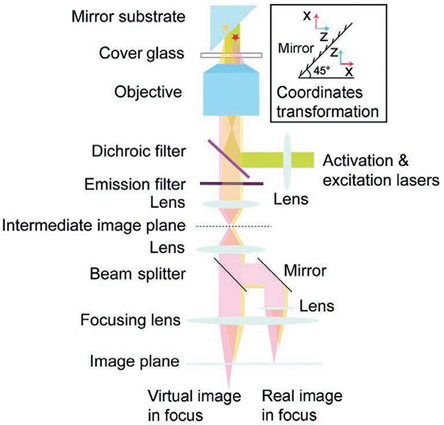
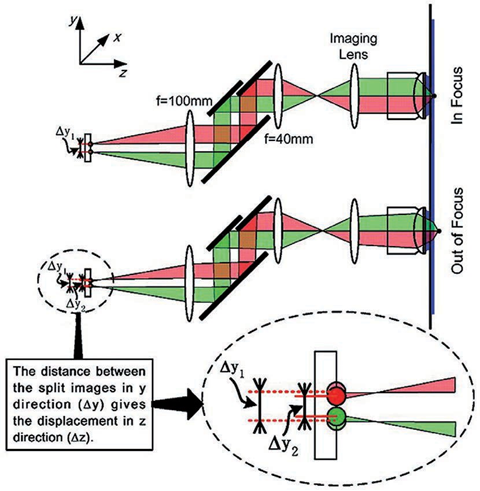
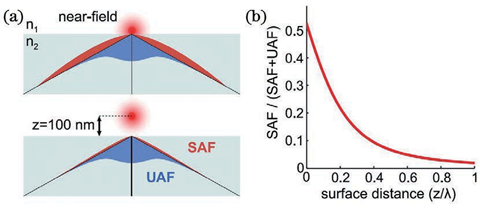
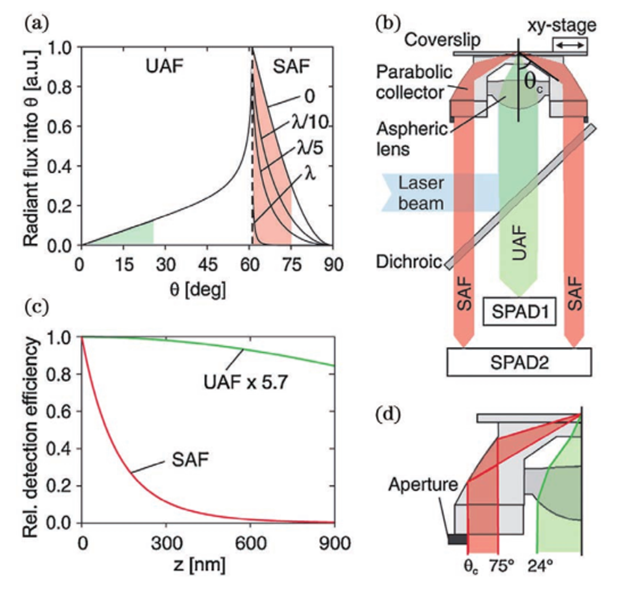
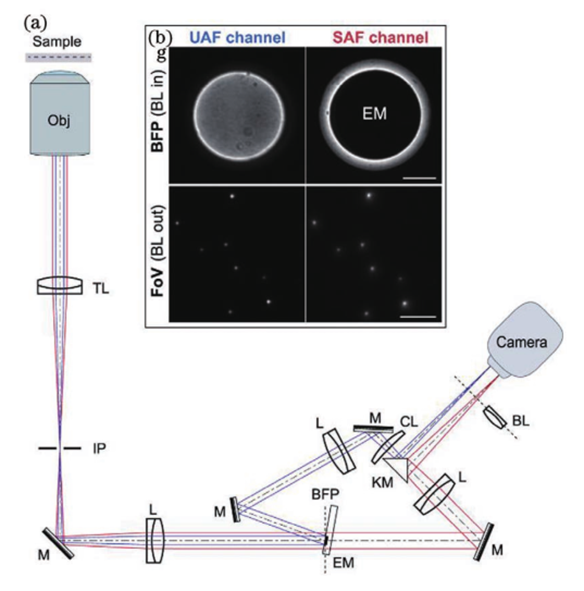
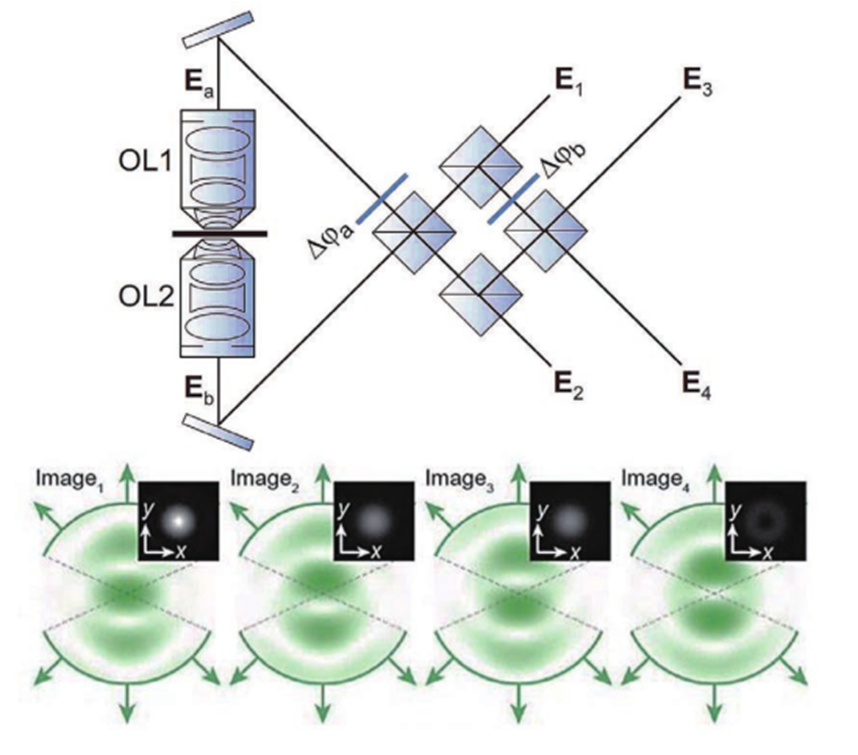
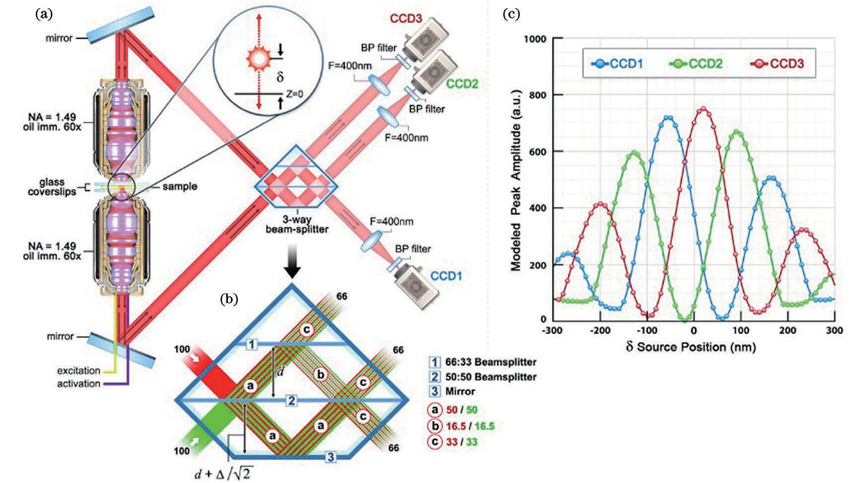
基于此技术,2010年研究人员提出了一种虚体积超分辨成像显微镜(VVSRM),并将其应用于PALM/FPALM 和PAINT。如图11所示,他们制作了一种反射镜基底,倾斜的反射镜可以对荧光分子侧面进行反射成像,通过分束镜和辅助透镜可将实像和离焦的反射像同时成像在同一个平面上,再对横向定位的结果进行坐标变换,即可实现轴向定位。当反射镜倾斜角度为45°时,理论上可以实现空间上各向同性的分辨率,各向同性也使得其体积测量的准确度高于共聚焦显微镜。若光子数超过5000,则定位精度能达到亚20nm。不难看出在VVSRM 中加入反射镜基底,不但补偿了分束镜带来的能量损失,而且减小了轴向漂移和像差的影响。然而,反射镜基底也带来了不利的因素,例如样品制备的难度增大。最早引入视差的方法通常是在物镜后焦面或者后焦面的共轭面加入楔形棱镜或者反射镜以将成像光路按角度分成两个通道,使得物体的轴向位移表现为两个横向图像之间相对位置的改变,在 3D SPT中都可以达到纳米级的精度。图12 为反射镜三维成像示意图。2019年,研究人员首次提出傅里叶光场显微镜(FLFM)。他们通过将微透镜阵列放在成像光路的傅里叶面上的方法引入视差,实现了小鼠肾脏切片的传统三维显微成像3~5μm 的分辨率。2020年研究人员将此技术引入 SMLM 中,并将其命名为单分子光场显微镜(SMLFM),分辨率得到了显著提升。如图 13 所示,在探测器的接收面上,MLA 将成像光路在横向上划分为二维阵列,阵列的每个区域都可以测量光场的四维信息以及二维空间和角度信息。每个微透镜都会对物体的一部分波前进行成像,若物体发生轴向位移,则在阵列的不同区域,其图像的横向位置会朝着孔径波前平均梯度的方向移动,并且位移长度与平均梯度成比例关系。例如,当物体靠近物镜,图像向阵列中心外侧移动;反之,图像向中心内侧移动。通过理论模型进行计算即可获取轴向位置信息,因此微透镜阵列可以测量光场的五维信息。样品和玻璃界面之间存在折射率不匹配的情况,这对在分界面附近的荧光分子辐射角度分布有很大影响。在距离分界面的一定范围内,荧光分子辐射的一部分荧光会以低于临界角的范围射入玻璃,称为低临界角荧光(UAF);另一部分荧光则会以超过临界角的范围入射,称为超临界角荧光(SAF)。根据折射定律,在几何光学中SAF 是不可能存在的,SAF 也因此被称为“禁止的光线”。但是,从物理光学的角度分析,荧光分子所辐射的倏逝分量会在分界面另一侧的介质(如玻璃)中传播,并且会随着荧光分子和分界面的距离的增加而急剧下降。因此,SAF 的能量贡献会随着此距离的增加而急剧下降,而在此范围内 UAF 的能量贡献几乎不变。如图14 所示,当荧光分子与分界面(z=0nm)接触时,SAF光子数大致等于总光子数的一半;当荧光分子与分界面距离大于等于λ(z≥λ)时,SAF光子数几乎为0,并且光子数随着其与分界面距离的增加呈指数形式下降。基于此原理,2004年研究人员首次提出超临界角荧光显微镜(SAFM),用于在共聚焦显微镜中同时分析荧光分析物表面结合和未结合部分的相关信息。2010年他们提出3D-SAFM技术,并将其应用在三维显微成像中。如图15所示,在3D-SAFM中,SAF和UAF分别由抛物面型聚光器和物镜收集,,角度范围分别为60°~75°(最小角度可通过光阑调节)和0°~24°。在一定范围内,UAF的能量分布与激光相同,相比于SAF几乎没有改变,因此可以使用SAF和UAF的比值和轴向位置的关系进行定位,而且SAF还避免了外界因素对成像釆集过程中漂移的影响。2015 年研究人员将dSTORM 与SAFM结合,提出一种可直接进行轴向定位探测的光学纳米显微系统(DONALD)。在 DONALD 中,他们使用高数值孔径(0.49NA )的物镜来收集包含 SAF在内的落射荧光,在成像光路的 DONALD 模块中,落射荧光被分束镜分为两部分,一部分为 SAF 和UAF,另一部分为UAF(SAF 被光阑阻挡)。因为在高 NA 物镜的后焦面(共轭面)上,SAF 和远场UAF 在径向上是分开的,所以可以将 UAF 和SAF 分开。这样在 EMCCD 平面上,可以通过将落射荧光与 UAF 相减得到 SAF,再计算SAF 与 UAF 的比值,实现轴向定位。理论上,DONALD可以实现5~10nm 的轴向定位精度。但是,在实际成像时,DONALD 的轴向定位精度可以达到约15nm;在对细胞结构(如细胞纤维型肌动蛋白和微管)成像时,轴向分辨率为40~80nm,且随着深度的增大,分辨率逐渐降低。这是因为分束器导致 UAF 和 SAF 的能量都被舍弃了50%,用于轴向定位的光子数减少,信噪比降低,外加像差的影响,DONALD 的定位精度和理论值有所差距。如图 16 所示,在 dSALM 的系统中,研究人员使用一种定制的椭圆形反射镜在后焦面上将SAF 从落射荧光中直接分离出来。在 UAF 所在光路中,他们通过加入柱透镜引入较弱的像散,用于横向定位和精度较低的轴向定位。在定位算法方面,dSALM 的直接分离法让其定位精度得到 4 倍的提高、有效景深得到4倍的增大。在对荧光珠的3D成像和DNA 折纸四面体的3D DNA-PAINT成像中,各个方向上的定位精度均为4~5nm,分辨率可以达到30nm;在对细胞网格蛋白小窝和微管的3D DNA-PAINT 成像中,分辨率可以达到50nm。此方法虽然提升了定位精度,但是dSALM 引入了弱像散,导致成像深度较大时定位精度无法得到保证,因此其单次成像定位的深度较小,实验中最大成像深度为600nm。此外,dSALM 使用高数值孔径(1.7NA)物镜所需的高折射率油镜,导致其无法使用光激活荧光染料;较大的视场像差将视场限制在20μm。当然,除了使用分离 UAF 和 SAF 的方法进行三维成像,还可以使用其他系统结构较为简单的方法,例如离焦。但是,离焦产生的像差会影响定位精度和校正曲线的绘制。由于单个物镜最多只能收集一半球形波前,在不牺牲横向分辨率的情况下,很难实现轴向分辨率的提升。但是,如果可以在成像系统的焦平面的另一侧上也放置一个物镜(共焦面物镜)收集波前的另一半,这样可以得到近乎完整的球形波前,由于恢复了对称性,PSF 的轴向延展也会大大减小,各向同性分辨率也因此实现,并且收集的光子数也提升了1倍。基于此理念,在20 世纪90 年代 研究人员提出了4Pi显微镜(4Pi microscopy)。如图17所示,因为一个物镜在理论上最多可以覆盖空间立体角的一半(2π),所以两个相对的物镜可以实现全空间立体角(4π),故将其命名为4Pi显微镜。实际上,空间立体角通常可以实现 2.5π~3π。在SMLM中使用4Pi可将干涉条纹中的相位信息转化为轴向位置信息,进而提高轴向分辨率,目前已经实现了4通道同时记录相位信息的成像系统。2009 年研究人员首次将 PALM 与 4Pi结合,并将其命名为干涉测量型 PALM(iPALM)。如图18所示,iPALM使用3通道分束器将荧光分成3个光束并产生自干涉,且每个通道之间的相位差为π/3,找到每帧图像中荧光分子的中心即可实现横向定位;对于轴向定位,同时获取3个通道中同一荧光分子的强度并通过强度与轴向位置的关系曲线,即可得到该分子的相对轴向位置,最终实现三维定位。iPALM 的 横向和轴向定位精度分别为20nm 和10nm,对生物细胞结构进行三维成像时可以达到20nm 以下的三维分辨率,因此iPALM可以清晰分辨出细胞微管、质膜、内质网等细胞结构,在这其中轴向分辨率最高可以达到10nm左右。当然,iPALM 也有局限性,由于他们把荧光波前当作平面波来分析,iPALM 的成像定位深度较小,仅为225nm。若想扩大轴向定位范围,则可以将iPALM 与其他技术相结合,不过其他技术的缺陷也可能会被引入其中。2008年研究人员首次提出了将4Pi应用于SMLM 的方案,并且提出了4通道分束器的概念。对于单个分子定位,此方案理论上可以实现5~10nm 的三维分辨率。2011年,他们报道了4Pi单分子开关显微镜,并成功实现了双色三维成像。4Pi-SMS采用了一种三角形4Pi腔,4Pi干涉腔的每个臂上都加入了一个1/4 波片(光轴与安装面呈45°)和巴比涅-索雷补偿器,使得p偏振光相对于s偏振光分别产生 Δϕa 和 Δϕb 的相位延迟,并且保证 Δϕa-Δϕb=π/2。最终,通过倾斜反射镜在空间上将荧光根据偏振态和传播方向分成4个通道并同时成像在同一相机上。对于轴向定位范围超过λ/2的荧光分子,分子的轴向位置之差为λ/2 的整数倍时,会导致干涉图案相同,使得轴向定位不准确,进而导致图像中包含轴向偏移的伪像。为此,他们不仅计算了相机上荧光分子高斯加权强度的全局相位,还计算了其高斯加权第三中心矩阵的全局相位。因此,在成像深度为1.5λ(~650nm)时,4Pi-SMS的轴向分辨率至少为5.4~6.6nm,横向分辨率为8.3~22.3nm。于是,4Pi-SMS被应用于人体血小板和哺乳动物微管的三维成像中,成像深度为700~1000nm。此外,相比于iPALM,4Pi-SMS 的多色成像也较容易实现,只需在原本的光路中加入一个二向色镜,通过透过率和不同偏振态之间的关系以及两种偏振态的能量比率判断染料种类,实现多色成像。为了进一步增大成像深度, 2016年研究人员提出了一种全细胞4Pi单分子开关纳米显微镜 (W-4PiSMSN)。虽然前人解决了厚度大于250nm的样本存在伪像的问题,但是若想实现对厚度为5~10μm 的哺乳动物的全细胞成像,4Pi-SMS依然会受到定位密度和像差的影响。如图19所示,为了在哺乳动物细胞的全厚度上实现10~20nm 的三维分辨率,他们改进了4Pi-SMS的系统设计,在4Pi干涉腔的每个臂中都加入了可变形镜,用于校正系统的各种像差和优化 PSF;其次,他们根据Brown等提出的4Pi-PSF 偏心距分析算法进行改进,将4Pi-PSF 的干涉相位(可以进行精确的轴向定位,不能区分干涉峰)及其包含像散的偏心距(可以将轴向定位范围缩小到每个干涉峰,不能提供干涉精度)所提供的信息共同用于轴向定位。因此,使用 W-4PiSMSN 对噬菌体、核孔和纤毛等细胞结构进行大体积三维成像,其三维分辨率均可达到10~20nm,并且成像深度可达10μm左右。综上所述,4Pi-SMS的确可以实现很高的分辨率,相比于其他技术有很大的优势。但是,4Pi-SMS的系统复杂程度较高,成本较高,搭建周期长(通常为1年),存在较多的不稳定性,因此全世界仅有少数实验室拥有4Pi-SMS,这也限制了4Pi-SMS在世界各地生物实验室中的广泛应用。参考资料:
王潇,涂世杰等, 三维超分辨显微成像技术的研究进展,激光与光电子学进展


 下载APP
下载APP

















