国内AI团队设计新冠药物,无模板从头蛋白质设计新突破,AI制药迎来新曙光

去年 AlphaFold2 将蛋白质结构预测推上了里程碑式的水准,该领域的进步为当前较为困难的蛋白质设计研究提供了新思路,也为药物设计、合成生物学的发展打开了新的窗口。
当前,在从头设计具有新结构和功能的蛋白质,大部分是使用 RosettaDesign 方法进行的。但是它生成的蛋白质要么通过参数改变现有结构模块(或模板)之间的相对几何形状来设计螺旋束或重复蛋白质,要么通过组装现有结构的肽片段来构建,终究还是要依托已知的天然蛋白质结构。
日前,天壤 X-lab 团队利用自主研发的蛋白质结构预测平台 TRDesign,不依靠任何已知的天然蛋白质结构,从头设计生成了新冠刺突蛋白结合剂,可以阻止刺突蛋白和宿主 ACE2 蛋白(SARS-CoV-2 进入细胞所需的受体)结合,从而阻断新冠病毒的入侵。
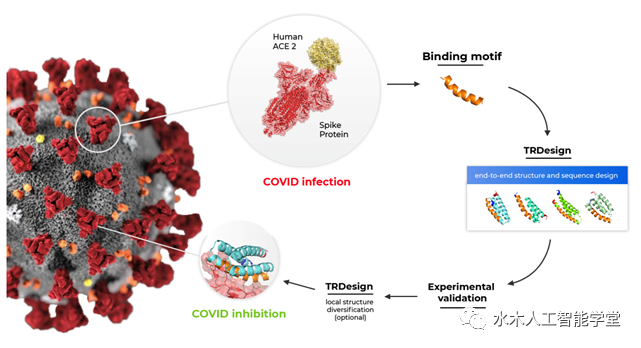
图示:天壤新冠刺突蛋白结合剂设计流程。
这说明基于 TRDesign 的蛋白质药物设计方法,可以不再受已知天然蛋白质的功能区域的制约,更加自由机动地设计蛋白质。从另一个方面讲,也意味着科学家可以不再依赖传统的药物发现方法,主动设计治疗性蛋白质,而不是被动地寻找发现。
天壤团队基于强化学习和自学习领域的见解,正结合实验自动化,设计一个全智能化的湿实验平台。目前,该团队正在积极推进新冠刺突蛋白结合剂的湿实验流程。
「以 AI 为主导的蛋白质设计方式与传统 AIDD 截然不同。我们已经基于 AI 构建了高效的蛋白质设计平台。后续,天壤还将建设智能湿实验室,以AI 为内核、依靠实验数据的反馈来建立自我强化学习的实验体系,真正超越传统化学和生物学方法;未来,以规模化的方式加快探索更具有价值的蛋白质和人类疾病的潜在疗法。我们相信 AI 有巨大的潜力能够站在一个更高的视野理解生命、设计生命、拓宽生命的广度。」天壤 X-lab 负责人苗洪江博士介绍。
传统的蛋白质开发、酶工程优化通常以天然蛋白质为基础,采用突变或定向进化的办法对其进行改造和修饰。研发耗时长、费用高,应用范畴也被局限于已知天然蛋白质的功能区域内,很难满足人们对于生物药、工业食品酶等的广泛需求。
以 AI为内核的方法则可以通过大量学习蛋白质序列与结构功能的关系,从而准确探索出蛋白质可折叠空间所有潜在的可能性。这是因为AI将在蛋白质折叠中学到的序列-结构-功能关联反向映射,突破了之前蛋白质设计方法计算复杂粗糙且需要主侧链反复迭代更新的难题,从而高效地生成氨基酸序列。
天壤 X-lab 根据 TRFold 预先创建的数据集进行训练,其序列生成更加自由机动,甚至可以生成「不存在」的蛋白质。
团队进行人工蛋白质药物开发的核心思路,主要由三大部分组成:通过 TRDesign 大量生成序列和结构,充分探索蛋白质主、侧链结构空间的多样性和可变性;TRFold 对结构和功能进行验证;TRDevPred 对设计结构进行局部优化,增强候选蛋白质稳定性、溶解性等需求属性。
研究人员表示,这样可以快速生成抗体、多肽、酶、细胞因子生物类似物,以及其他具有特定功能的、自然界不存在的蛋白质药物。从理论上讲,它似乎可以满足众多疾病的治疗需求;但其究竟其效果如何,还有待在实验室中进一步验证。
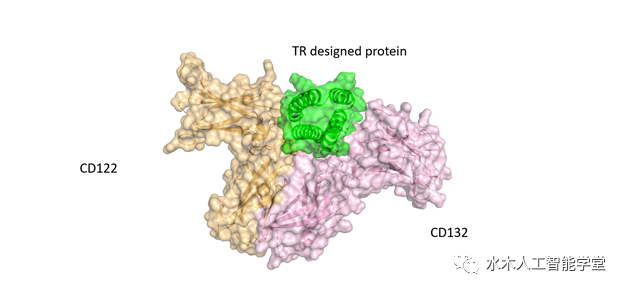
图示:天壤从头设计的IL-2类似物能够激活特定淋巴细胞,同时避免当前IL-2类药物毒性。
另外,天壤团队还对肿瘤免疫治疗药物 IL-2(白细胞介素 2)类似物进行了从头设计,提高了其对免疫系统的激活作用,大大降低了药物的毒性和免疫抑制;并且 TRDesign 所设计的蛋白药物不足 100 个氨基酸,具有极强的稳定性和极低的免疫原性。
以 AI 主导的蛋白药物设计可以重新定义疾病的可治疗空间,突破天然蛋白质功能限制,扩大技术的延展性和广度,并部分替代实验实现降本增效,未来也许能将新药研发周期缩短至 1-2 年内。
这种新的设计方式还可以推广到材料设计、食品生产、能源开发、气候改造、环境保护、人类健康等众多领域。未来,也必将吸引更多的企业、研究机构加入。随着 AI 技术的逐渐成熟,一个高效且低成本的蛋白质研发时代必将到来。
文献来源:机器之心
版权声明:本号内容部分来自互联网,转载请注明原文链接和作者,如有侵权或出处有误请和我们联系。
