Nature Milestones | 近20年人类癌症研究领域14项里程碑式进展!

导 读
时 间 线

事 件 简 介
01
Routes to resistance
(靶向治疗耐药机制的研究进展)

02
Tracking cancer in liquid biopsies(液体活检对患者的非侵入性诊断和监测)

03
When cancer prevention went viral (预防宫颈癌的HPV疫苗)
04
A licence to kill
(利用合成致死进行癌症治疗)

05
Sitting on the fence (癌基因在癌前组织和癌症中诱导的衰老)
06
Not a simple switch
(癌症中的代谢适应)

07
Sequencing the secrets of the cancer genome (首次癌症全基因组测序 )

08
Unleashing the immune system against cancer (免疫检查点抑制剂)
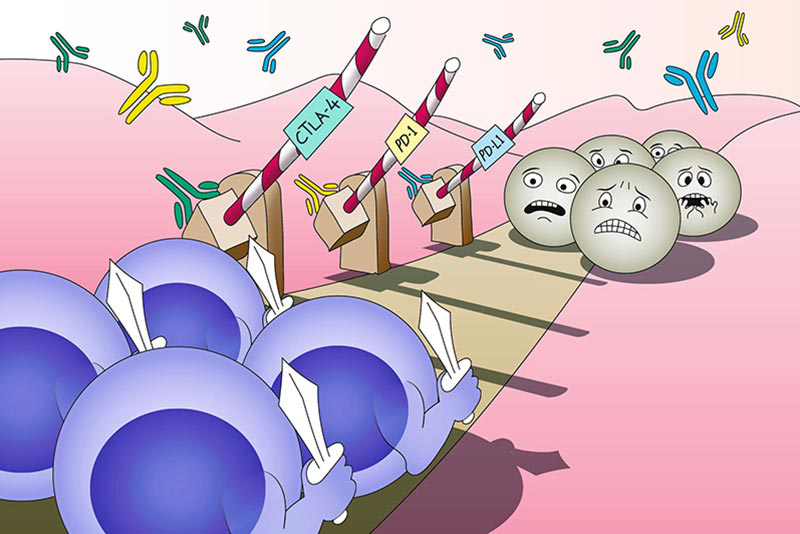
09
Engineering armed T cells for the fight (改造T细胞以杀死癌细胞)

10
Oncohistones: epigenetic drivers of cancer(肿瘤发生和发展的表观遗传学驱动因素)
11
Tumour evolution: from linear paths to branched trees(肿瘤细胞克隆多样性是肿瘤进展和治疗抵抗的基础)

12
Undruggable? Inconceivable(靶向“无法下药”的非激酶蛋白)

13
Good bacteria make for good cancer therapy(肠道微生物群对抗肿瘤免疫应答的影响)
14
The AI revolution in cancer(人工智能在癌症诊断和监测中的潜力)

往期精品(点击图片直达文字对应教程)
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集
(请备注姓名-学校/企业-职务等)



























